题目内容
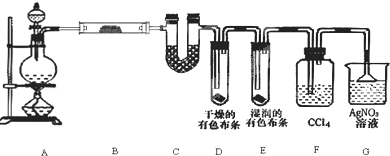
3.某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如图装置进行实验(实验室制取氯气的反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O):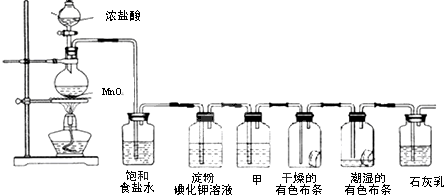
请按要求回答下列问题:
(1)饱和食盐水的作用是除去氯气中的氯化氢.
(2)淀粉碘化钾溶液中观察到的现象是溶液变蓝.
(3)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放浓硫酸(填名称).
(4)C12与石灰乳反应制取漂白粉,漂白粉的有效成分是次氯酸钙.
(5)该兴趣小组用8.7gMnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl22.24L.
(6)某氯碱工厂的氯气管道发生泄漏,以下采取的措施正确的是AC(填序号).
A.将人群向高处疏散
B.将人群向低处疏散
C.关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位
D.关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位.
分析 (1)浓盐酸易挥发,制备的氯气中含有氯化氢,依据氯化氢、氯气的性质选择合适的除杂剂;
(2)氯气具有强的氧化性,能够氧化碘离子生成单质碘;
(3)要使干燥的有色布条不褪色,湿润的有色布条褪色,则甲的作用是干燥氯气,依据氯气的性质选择干燥剂;
(4)漂白粉有效成分是次氯酸钙;
(5)根据反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,87gMnO2完全反应生成氯气1mol,所以8.7g MnO2与足量的浓盐酸生成氯气的物质的量是1mol,据此解答;
(6)氯气是黄绿色有毒气体,密度比空气大,且氯气的溶解性较小,1体积的水能溶解2体积的氯气,氯气能和水反应生成酸,所以氯气能和碱反应生成盐和水.
解答 解:(1)盐酸易挥发,所以制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和水反应生成盐酸和次氯酸,饱和食盐水中含有氯离子,能抑制氯气的溶解,所以饱和食盐水的作用是除去氯化氢杂质气体,
故答案为:除去氯气中的氯化氢;
(2)氯气具有强的氧化性,能够氧化碘离子生成单质碘,单质碘遇到淀粉变蓝,所以会看到现象:溶液变蓝色,故答案为:溶液变蓝色;
(3)甲的作用是干燥氯气,则甲中盛放浓硫酸干燥氯气,故答案为:浓硫酸;
(4)漂白粉有效成分是次氯酸钙,故答案为:次氯酸钙;
(5)根据反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,理论上87gMnO2完全反应生成氯气1mol,所以8.7g MnO2与足量的浓盐酸生成氯气的物质的量是0.1mol,标况下气体体积为:0.1mol×22.4L/mol=2.24L,
故答案为:2.24;
(6)A、氯气的密度大于空气的密度,所以和空气混合时,氯气在下方,空气在上方,所以发生氯气泄漏时,不能向地势低的地方撤离,应向高处疏散,故A正确;
B、氯气的密度大于空气的密度,所以和空气混合时,氯气在下方,空气在上方,所以发生氯气泄漏时,不能向地势低的地方撤离,应向高处疏散,故B错误;
C、氯气能和水反应生成酸,所以氯气能和碱反应生成盐和水,关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位,避免氯气逸出,故C正确;
D、氯气水中的溶解性较小,关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位,不能很好的吸收氯气,故D错误;
故选AC.
点评 本题考查了氯气的实验室制法和氯气的性质,是高考题常考内容,熟悉氯气制备原理和氯气的性质是解题关键,题目难度不大,注意对基础知识的积累.

 名校课堂系列答案
名校课堂系列答案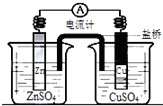
| A. | 铜是阳极,铜片上有气泡产生 | |
| B. | 锌离子在锌片表面被还原 | |
| C. | 正极附近的SO${\;}_{4}^{2-}$离子浓度逐渐增大 | |
| D. | 盐桥中的阳离子会移向CuSO4溶液 |
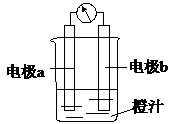 课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论不正确的是( )
课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论不正确的是( )| A. | 原电池是将化学能转化成电能的装置 | |
| B. | 原电池由电极、电解质溶液和导线等组成 | |
| C. | 右图中a极为镁条、b极为锌片时,导线中会产生电流 | |
| D. | 右图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片 |
| A. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 | |
| B. | 一个化学反应是吸热还是放热,取决于反应物和生成物总能量的相对大小 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 |
| A. | 汽油、煤油、植物油均为含碳氢氧三种元素的化合物 | |
| B. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,且都有同分异构体 | |
| C. | 乙酸与丙二酸互为同系物 | |
| D. | 苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴 |
| A. | 铝、氧化铝中铝元素微粒的半径r(Al3+)<r(Al) | |
| B. | 工业上可用铝热反应的方法提取镁 | |
| C. | 在铝热反应中化学能全部转化为光能 | |
| D. | 在铝热反应中铁的还原性大于铝的还原性 |