题目内容
12.下列说法不正确的是( )| A. | 纯碱不是碱 | B. | 甘油不是油 | C. | 双氧水不是水 | D. | 醋酸不是酸 |
分析 A、根据纯碱是碳酸钠的俗称,结合其化学式判断;
B、甘油是丙三醇的俗称;
C、双氧水是过氧化氢的俗称;
D、醋酸是乙酸的俗称,据此回答.
解答 解:A、纯碱的化学式为Na2CO3属于盐,不是碱,故A正确;
B、甘油是丙三醇,属于醇类物质,不属于油(酯类),故B正确;
C、双氧水是H2O2,不是水,故C正确;
D、醋酸是乙酸的俗称,是弱酸,和碱发生中和反应,故D错误.
故选D.
点评 本题主要考查了常见物质的俗称,根据名称对应的具体物质的化学式和物质种类分析,题目难度较易.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
19. 对氯苯甲酸是一种药物中间体,可用对氯甲苯为原料,通过高锰酸钾氧化法制备.反应如下:
对氯苯甲酸是一种药物中间体,可用对氯甲苯为原料,通过高锰酸钾氧化法制备.反应如下:
Ⅰ.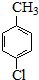 $→_{催化剂}^{KMnO_{4}}$
$→_{催化剂}^{KMnO_{4}}$
Ⅱ.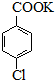 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$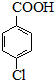
有关化合物的物理性质如下表:
实验步骤:
①在规格为250mL的三颈烧瓶(装置A)中加入一定量的催化剂、适量KMnO4、100mL水;
②如图安装好装置,在分液漏斗(装置C)中加入6.00mL对氯甲苯,加热至93℃时,逐滴滴入对氯甲苯;
③控制温度在93℃左右,反应2h后,过滤,洗涤滤渣,将洗涤液与滤液合并,加入稀硫酸酸化;
④加热浓缩、冷却结晶、过滤,洗涤滤渣,干燥后称量其质量为wg.
请回答下列问题:
(1)装置B的名称是冷凝管.
(2)下列有关实验的说法不正确的是AB
A.量取6.00mL对氯甲苯可选用25mL碱式滴定管
B.装置B中水流方向可从b口进a口出
C.控制温度在93℃左右,最好采用水浴加热
D.取步骤④最后一次洗涤液少量于试管中,向其中滴入BaCl2溶液,可检验滤渣是否洗涤干净
(3)步骤②中对氯甲苯的加入方法是逐滴加入而不是一次性加入,理由是减少对氯甲苯的挥发,提高原料利用率.
(4)步骤③中过滤的目的是除去MnO2,滤液中加入稀硫酸酸化,可观察到的实验现象是产生白色沉淀.
(5)洗涤滤渣最合适的洗涤剂,步骤③是C,步骤④是B.
A.乙醇 B.冷水 C.热水 D.滤液
(6)若用M1表示对氯甲苯的式量、M2表示对氯苯甲酸的式量,则本实验产率的计算表达式为$\frac{w}{\frac{6×1.07{M}_{2}}{{M}_{1}}}$×100%(不要求计算).
 对氯苯甲酸是一种药物中间体,可用对氯甲苯为原料,通过高锰酸钾氧化法制备.反应如下:
对氯苯甲酸是一种药物中间体,可用对氯甲苯为原料,通过高锰酸钾氧化法制备.反应如下:Ⅰ.
 $→_{催化剂}^{KMnO_{4}}$
$→_{催化剂}^{KMnO_{4}}$
Ⅱ.
 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$
有关化合物的物理性质如下表:
| 熔点/℃ | 沸点/℃ | 密度/g•cmˉ3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐,溶解度随温度升高而增大 | ||||
①在规格为250mL的三颈烧瓶(装置A)中加入一定量的催化剂、适量KMnO4、100mL水;
②如图安装好装置,在分液漏斗(装置C)中加入6.00mL对氯甲苯,加热至93℃时,逐滴滴入对氯甲苯;
③控制温度在93℃左右,反应2h后,过滤,洗涤滤渣,将洗涤液与滤液合并,加入稀硫酸酸化;
④加热浓缩、冷却结晶、过滤,洗涤滤渣,干燥后称量其质量为wg.
请回答下列问题:
(1)装置B的名称是冷凝管.
(2)下列有关实验的说法不正确的是AB
A.量取6.00mL对氯甲苯可选用25mL碱式滴定管
B.装置B中水流方向可从b口进a口出
C.控制温度在93℃左右,最好采用水浴加热
D.取步骤④最后一次洗涤液少量于试管中,向其中滴入BaCl2溶液,可检验滤渣是否洗涤干净
(3)步骤②中对氯甲苯的加入方法是逐滴加入而不是一次性加入,理由是减少对氯甲苯的挥发,提高原料利用率.
(4)步骤③中过滤的目的是除去MnO2,滤液中加入稀硫酸酸化,可观察到的实验现象是产生白色沉淀.
(5)洗涤滤渣最合适的洗涤剂,步骤③是C,步骤④是B.
A.乙醇 B.冷水 C.热水 D.滤液
(6)若用M1表示对氯甲苯的式量、M2表示对氯苯甲酸的式量,则本实验产率的计算表达式为$\frac{w}{\frac{6×1.07{M}_{2}}{{M}_{1}}}$×100%(不要求计算).
3.乳酸(2-羟基丙酸)为无色液体,与水混溶,弱挥发挥.它在多种生物化学过程中起作用.某学习小组研究利用发酵法制乳酸菌以及探讨乳酸的部分性质.

实验(一):乳酸的制取
步骤1:取14.40g葡萄糖(相对分子质量为180于烧杯中,加入乳酸菌(厌氧)发酵,72小时后,过滤,将滤液转移到仪器A中,定容,得到500mL原液;
步骤2:取20.00mL原液于锥形瓶中,加入酚酞作指示剂,用浓为0.1000mol/L的NaOH溶液滴定至终点,重复4次,数据记录如下表.(假定原液中其他物质不与NaOH反应)
(1)仪器A是500mL容量瓶;
(2)如何判断已到达滴定终点当滴入最后一滴标准液时,锥形瓶中无色溶液变红色,且半分钟内不褪色;
(3)乳酸的产率为30%.
实验(二):乳酸的性质
已知乳酸的Ka=1.4×10-4,碳酸的Ka1=4.47×10-3
(4)设计实验证明乳酸是弱酸:取0.1mol/L乳酸溶液于烧杯中,用PH计测定其PH值,若PH大于1,说明乳酸是弱酸或(常温下取0.1mol/L乳酸钠溶液于烧杯中,用pH计测定其PH值,若PH大于7,说明乳酸是弱酸)或(取PH=a乳酸溶液于烧杯中,加水稀释10n倍,用PH计测定其PH值,若PH小于a+n说明乳酸是弱酸).
(5)小组利用如图所示的仪器和药品,通过实验来比较乳酸与碳酸的酸性强弱.

①可观察到烧杯中的现象是溶液出现白色浑浊;写出烧杯中发生的化学反应方程式2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3或NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3;
②学习小组中有成员提出上述实验设计不够严谨,请你提出改进的措施在A与B之间增加一个装有碳酸氢钠溶液的洗气瓶.

实验(一):乳酸的制取
步骤1:取14.40g葡萄糖(相对分子质量为180于烧杯中,加入乳酸菌(厌氧)发酵,72小时后,过滤,将滤液转移到仪器A中,定容,得到500mL原液;
步骤2:取20.00mL原液于锥形瓶中,加入酚酞作指示剂,用浓为0.1000mol/L的NaOH溶液滴定至终点,重复4次,数据记录如下表.(假定原液中其他物质不与NaOH反应)
| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |
(2)如何判断已到达滴定终点当滴入最后一滴标准液时,锥形瓶中无色溶液变红色,且半分钟内不褪色;
(3)乳酸的产率为30%.
实验(二):乳酸的性质
已知乳酸的Ka=1.4×10-4,碳酸的Ka1=4.47×10-3
(4)设计实验证明乳酸是弱酸:取0.1mol/L乳酸溶液于烧杯中,用PH计测定其PH值,若PH大于1,说明乳酸是弱酸或(常温下取0.1mol/L乳酸钠溶液于烧杯中,用pH计测定其PH值,若PH大于7,说明乳酸是弱酸)或(取PH=a乳酸溶液于烧杯中,加水稀释10n倍,用PH计测定其PH值,若PH小于a+n说明乳酸是弱酸).
(5)小组利用如图所示的仪器和药品,通过实验来比较乳酸与碳酸的酸性强弱.

①可观察到烧杯中的现象是溶液出现白色浑浊;写出烧杯中发生的化学反应方程式2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3或NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3;
②学习小组中有成员提出上述实验设计不够严谨,请你提出改进的措施在A与B之间增加一个装有碳酸氢钠溶液的洗气瓶.
7.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3kJ | |
| C. | 300℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | 由C(石墨)=C(金刚石)△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 |
1.根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
| A. | 氯气与氢气化合比溴与氢气化合容易 | |
| B. | 硒化氢比硫化氢稳定 | |
| C. | 氢氧化锶比氢氧化钙的碱性强 | |
| D. | 铍的原子失电子能力比镁弱 |
2.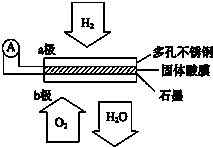 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )| A. | 电子通过外电路从b极流向a极 | |
| B. | b极上的电极反应式为:O2+2H2O+4e-=4OH- | |
| C. | 每转移0.1 mol电子,消耗标准状况下1.12 L的H2 | |
| D. | OH-由a极通过固体酸电解质传递到b极 |

 ,氢元素含量最高的烃的分子式CH4.
,氢元素含量最高的烃的分子式CH4.