题目内容
3.乳酸(2-羟基丙酸)为无色液体,与水混溶,弱挥发挥.它在多种生物化学过程中起作用.某学习小组研究利用发酵法制乳酸菌以及探讨乳酸的部分性质.
实验(一):乳酸的制取
步骤1:取14.40g葡萄糖(相对分子质量为180于烧杯中,加入乳酸菌(厌氧)发酵,72小时后,过滤,将滤液转移到仪器A中,定容,得到500mL原液;
步骤2:取20.00mL原液于锥形瓶中,加入酚酞作指示剂,用浓为0.1000mol/L的NaOH溶液滴定至终点,重复4次,数据记录如下表.(假定原液中其他物质不与NaOH反应)
| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |
(2)如何判断已到达滴定终点当滴入最后一滴标准液时,锥形瓶中无色溶液变红色,且半分钟内不褪色;
(3)乳酸的产率为30%.
实验(二):乳酸的性质
已知乳酸的Ka=1.4×10-4,碳酸的Ka1=4.47×10-3
(4)设计实验证明乳酸是弱酸:取0.1mol/L乳酸溶液于烧杯中,用PH计测定其PH值,若PH大于1,说明乳酸是弱酸或(常温下取0.1mol/L乳酸钠溶液于烧杯中,用pH计测定其PH值,若PH大于7,说明乳酸是弱酸)或(取PH=a乳酸溶液于烧杯中,加水稀释10n倍,用PH计测定其PH值,若PH小于a+n说明乳酸是弱酸).
(5)小组利用如图所示的仪器和药品,通过实验来比较乳酸与碳酸的酸性强弱.

①可观察到烧杯中的现象是溶液出现白色浑浊;写出烧杯中发生的化学反应方程式2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3或NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3;
②学习小组中有成员提出上述实验设计不够严谨,请你提出改进的措施在A与B之间增加一个装有碳酸氢钠溶液的洗气瓶.
分析 实验(一):(1)根据步骤1:得到500mL原液可知,仪器A是500mL容量瓶;
(2)乳酸与氢氧化钠恰好反应时生成乳酸钠,乳酸钠呈碱性,用酚酞作指示剂,酚酞在酸性溶液中显无色,在碱性溶液中显浅红色;滴定时,当滴至待测液变色且半分钟不恢复即为滴定终点;
(3)根据数据记录表数据分析,第三组数据误差大,为错误记录,不能作为有效数据,根据题干中其余三组数据计算消耗的氢氧化钠溶液体积的平均值,乳酸的产率=$\frac{实际产量}{理论产量}$×100%,根据质量守恒,14.40g葡萄糖理论产出乳酸14.40g;
实验(二):
(4)证明乳酸为弱酸,可证明存在电离平衡、部分电离以及对应的强碱盐的溶液的酸碱性等角度设计实验;
(5)①偏铝酸钠可以和少量二氧化碳反应生成氢氧化铝沉淀和碳酸钠;偏铝酸钠可以和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,现象是溶液出现白色浑浊;
②乳酸(2-羟基丙酸)为无色液体,与水混溶,易挥发,需排除乳酸的干扰.
解答 解:实验(一):(1)根据步骤1:过滤,将滤液转移到仪器A中,定容,得到500mL原液,说明仪器A为500mL容量瓶,
故答案为:500mL容量瓶;
(2)取20.00mL原液于锥形瓶中,加入酚酞作指示剂,用浓为0.1000mol/L的NaOH溶液滴定至终点,乳酸与氢氧化钠恰好反应时生成乳酸钠,乳酸钠呈碱性,酚酞在酸性溶液中显无色,在碱性溶液中显浅红色,所以判断已到达滴定终点为:当滴入最后一滴标准液时,锥形瓶中无色溶液变红色,且半分钟内不褪色,
故答案为:当滴入最后一滴标准液时,锥形瓶中无色溶液变红色,且半分钟内不褪色;
(3)根据数据记录表数据分析,第三组数据误差大,为错误记录,不能作为有效数据,所以消耗的氢氧化钠溶液的体积为:$\frac{19.22+19.18+19.20}{3}$=19.20mL,20.00mL原液中,n(乳酸)=n(NaOH)=CV=0.1000mol/L×19.20×10-3L=1.92×10-3mol,实际生产乳酸的质量为:m=nM=1.92×10-3mol×$\frac{500}{20}$×90g/mol=4.32g,
根据质量守恒,14.40g葡萄糖理论产出乳酸14.40g,所以乳酸的产率=$\frac{实际产量}{理论产量}$×100%=$\frac{4.32g}{14.4g}$×100%=30%,
故答案为:30%;
实验(二):(4)证明乳酸为弱酸,可证明存在电离平衡,取0.1mol/L乳酸溶液于烧杯中,用PH计测定其PH值,若PH大于1,说明乳酸是弱酸,或取PH=a乳酸溶液于烧杯中,加水稀释10n倍,用PH计测定其PH值,若PH小于a+n说明乳酸是弱酸,
测定该酸的钠盐溶液常温下的pH,若pH>7,说明为强碱弱酸盐,水解呈碱性,可说明为弱酸,常温下取0.1mol/L乳酸钠溶液于烧杯中,用pH计测定其PH值,若PH大于7,说明乳酸是弱酸,
故答案为:取0.1mol/L乳酸溶液于烧杯中,用PH计测定其PH值,若PH大于1,说明乳酸是弱酸或(常温下取0.1mol/L乳酸钠溶液于烧杯中,用pH计测定其PH值,若PH大于7,说明乳酸是弱酸)或(取PH=a乳酸溶液于烧杯中,加水稀释10n倍,用PH计测定其PH值,若PH小于a+n说明乳酸是弱酸);
(5)①偏铝酸钠可以和少量二氧化碳反应生成氢氧化铝沉淀和碳酸钠,反应的方程式为2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3,
偏铝酸钠可以和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,即NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3,可观察到烧杯中的现象是溶液出现白色浑浊,
故答案为:溶液出现白色浑浊;2NaAlO2+3H2O+CO2═2Al(OH)3↓+Na2CO3或NaAlO2+2H2O+CO2═Al(OH)3↓+NaHCO3;
②乳酸(2-羟基丙酸)为无色液体,与水混溶,易挥发,需在A与B之间增加一个装有碳酸氢钠溶液的洗气瓶,洗去二氧化碳中的乳酸,排除乳酸的干扰,
故答案为:在A与B之间增加一个装有碳酸氢钠溶液的洗气瓶.
点评 本题考查乳酸的性质实验,侧重于学生的分析能力和实验能力的考查,注意把握实验的角度和可行性的评价,明确弱电解质的判断方法,题目难度中等.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案| A. | 由X、Y、Z三种元素形成的某种化合物,可能含有离子键 | |
| B. | 五种元素分别形成的单核离子中,M的离子半径最大 | |
| C. | W的氯化物是由一种10e-离子和一种18e-离子构成的 | |
| D. | X元素与Z所在主族的各元素形成的A2B型化合物中X2Z沸点最低 |

| A. | 图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 | |
| B. | 图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 | |
| C. | 整个循环过程中产生1mol O2的同时产生44.8LH2 | |
| D. | 设计该循环是为了制取能源气体H2 |
| A. | 10:7:11 | B. | 11:11:8 | C. | 11:10:8 | D. | 10:11:8 |
| A. | 二氧化硫、氨、煤的液化均为物理变化 | |
| B. | 2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO | |
| C. | 甲醇、乙二醇、丙三醇都为饱和醇,熔沸点依次降低 | |
| D. | 已知常温下氢氧化镁的溶度积常数为a,则氢氧化镁悬浊液中:c(OH-)=$\root{3}{a}$mol/L |
| A. | 纯碱不是碱 | B. | 甘油不是油 | C. | 双氧水不是水 | D. | 醋酸不是酸 |
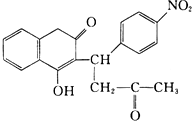
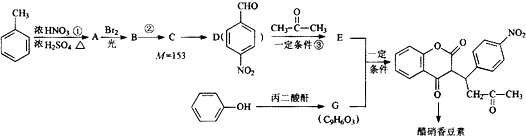
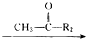 R1-CH═
R1-CH═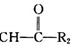 +H2O
+H2O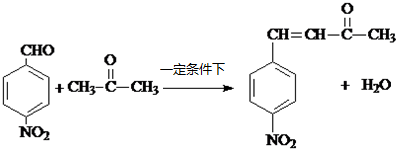 .
.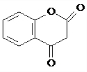 .
.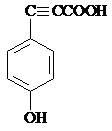 .
.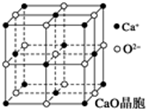 工业上,可以由下列反应合成三聚氰胺:
工业上,可以由下列反应合成三聚氰胺: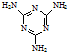 .其中氮原子的杂化方式有sp2、sp3.
.其中氮原子的杂化方式有sp2、sp3.