题目内容
19. 对氯苯甲酸是一种药物中间体,可用对氯甲苯为原料,通过高锰酸钾氧化法制备.反应如下:
对氯苯甲酸是一种药物中间体,可用对氯甲苯为原料,通过高锰酸钾氧化法制备.反应如下:Ⅰ.
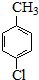 $→_{催化剂}^{KMnO_{4}}$
$→_{催化剂}^{KMnO_{4}}$
Ⅱ.
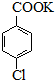 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$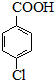
有关化合物的物理性质如下表:
| 熔点/℃ | 沸点/℃ | 密度/g•cmˉ3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐,溶解度随温度升高而增大 | ||||
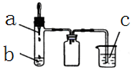
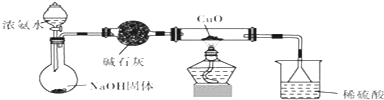
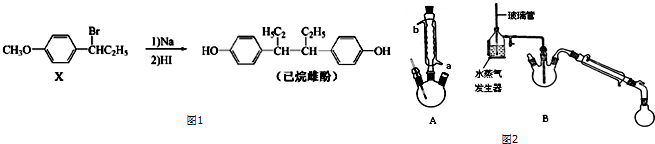
①在规格为250mL的三颈烧瓶(装置A)中加入一定量的催化剂、适量KMnO4、100mL水;
②如图安装好装置,在分液漏斗(装置C)中加入6.00mL对氯甲苯,加热至93℃时,逐滴滴入对氯甲苯;
③控制温度在93℃左右,反应2h后,过滤,洗涤滤渣,将洗涤液与滤液合并,加入稀硫酸酸化;
④加热浓缩、冷却结晶、过滤,洗涤滤渣,干燥后称量其质量为wg.
请回答下列问题:
(1)装置B的名称是冷凝管.
(2)下列有关实验的说法不正确的是AB
A.量取6.00mL对氯甲苯可选用25mL碱式滴定管
B.装置B中水流方向可从b口进a口出
C.控制温度在93℃左右,最好采用水浴加热
D.取步骤④最后一次洗涤液少量于试管中,向其中滴入BaCl2溶液,可检验滤渣是否洗涤干净
(3)步骤②中对氯甲苯的加入方法是逐滴加入而不是一次性加入,理由是减少对氯甲苯的挥发,提高原料利用率.
(4)步骤③中过滤的目的是除去MnO2,滤液中加入稀硫酸酸化,可观察到的实验现象是产生白色沉淀.
(5)洗涤滤渣最合适的洗涤剂,步骤③是C,步骤④是B.
A.乙醇 B.冷水 C.热水 D.滤液
(6)若用M1表示对氯甲苯的式量、M2表示对氯苯甲酸的式量,则本实验产率的计算表达式为$\frac{w}{\frac{6×1.07{M}_{2}}{{M}_{1}}}$×100%(不要求计算).
分析 一定量的对氯甲苯和适量KMnO4在93℃反应一段时间后停止反应生成对氯苯甲酸钾和二氧化锰,二氧化锰不溶于水,加入稀硫酸酸化,生成对氯苯甲酸,对氯苯甲酸属于可溶性盐,加热浓缩、冷却结晶、过滤,洗涤滤渣得对氯苯甲酸,
(1)根据仪器的图形判断;
(2)A.对氯甲苯是一种优良的有机溶剂,对橡胶制品有明显的溶解腐蚀作用;
B.冷凝管应该是逆向通水;
C.水浴加热受热均匀;
D.因加入稀硫酸酸化,可能含有硫酸根离子,根据检验硫酸根离子的方法;
(3)少量逐滴加入对氯甲苯可减少对氯甲苯的挥发,从而提高原料利用率;
(4)二氧化锰不溶于水,过滤可除去;对氯苯甲酸钾与稀硫酸反应生成对氯苯甲酸,对氯苯甲酸微溶于水,是白色沉淀;
(5)根据趁热过滤得到对氯苯甲酸钾以及对氯苯甲酸经冷却结晶得到;
(6)根据关系式: ~
~ 来计算.
来计算.
解答 解:(1)由仪器的图形可知,B为冷凝管;
故答案为:冷凝管;
(2)A.对氯甲苯是一种优良的有机溶剂,对碱式滴定管上橡胶制品有明显的溶解腐蚀作用,故A错误;
B.冷凝管应该是a进水b出水,使水与冷凝物充分接触,故B错误;
C.控制温度在93℃左右,最好采用水浴加热,溶液受热均匀,故C正确;
D.因加入稀硫酸酸化,可能含有硫酸根离子,所以取最后一次洗涤液少量于试管中,向其中滴入BaCl2溶液,可检验滤渣是否洗涤干净,故D正确;
故选AB.
(3)步骤②中对氯甲苯的加入方法是逐滴加入而不是一次性加入,理由是减少对氯甲苯的挥发,提高原料利用率;
故答案为:减少对氯甲苯的挥发,提高原料利用率;
(4)对氯甲苯和适量KMnO4反应生成对氯苯甲酸钾和二氧化锰,二氧化锰不溶于水,步骤③中过滤的目的是除去MnO2,滤液中加入稀硫酸酸化,对氯苯甲酸钾与稀硫酸反应生成对氯苯甲酸,对氯苯甲酸微溶于水,是白色沉淀;可观察到的实验现象是产生白色沉淀;
故答案为:除去MnO2;产生白色沉淀;
(5)根据趁热过滤得到对氯苯甲酸钾以及对氯苯甲酸经冷却结晶得到,所以洗涤滤渣最合适的洗涤剂,步骤③是热水,步骤④是冷水;
故答案为:C;B;
(6)6.00mL对氯甲苯完全反应可以得到对氯苯甲酸xg,
则:: ~
~
M1 M2
6.00×1.07 x
解得:x=$\frac{6×1.07{M}_{2}}{{M}_{1}}$
而实验制得wg对氯苯甲酸,所以本实验产率的计算表达式为$\frac{w}{\frac{6×1.07{M}_{2}}{{M}_{1}}}$×100%;
故答案为:$\frac{w}{\frac{6×1.07{M}_{2}}{{M}_{1}}}$×100%.
点评 本题考查有机物的合成,为高考常见的题型,注意把握合成流程中的反应条件、已知信息等推断各物质,熟悉有机物的结构与性质即可解答,题目难度中等.

 利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
利用如图所示装置进行下列实验,实验现象与结论均正确的是( )| 选项 | 实验试剂 | 实验现象 | 实验结论 | ||
| a | b | c | |||
| A | 浓氨水 | 碱石灰 | FeCl2溶液 | 产生白色沉淀,迅速变为灰绿色,最后变为红褐色 | 氨气具有氧化性 |
| B | 稀硫酸 | FeS | AgCl悬浊液 | 悬浊液由白色变为黑色 | Ksp(AgCl)>Ksp(Ag2S) |
| C | 浓硝酸 | 铜 | BaSO3悬浊液 | 悬浊液变澄清 | +4价硫具有还原性 |
| D | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 由X、Y、Z三种元素形成的某种化合物,可能含有离子键 | |
| B. | 五种元素分别形成的单核离子中,M的离子半径最大 | |
| C. | W的氯化物是由一种10e-离子和一种18e-离子构成的 | |
| D. | X元素与Z所在主族的各元素形成的A2B型化合物中X2Z沸点最低 |

| A. | 图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 | |
| B. | 图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 | |
| C. | 整个循环过程中产生1mol O2的同时产生44.8LH2 | |
| D. | 设计该循环是为了制取能源气体H2 |
| A. | 纯碱不是碱 | B. | 甘油不是油 | C. | 双氧水不是水 | D. | 醋酸不是酸 |
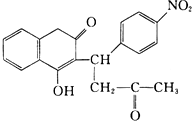
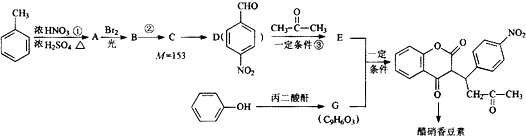
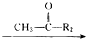 R1-CH═
R1-CH═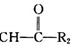 +H2O
+H2O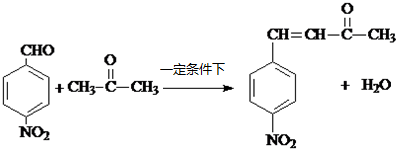 .
. .
.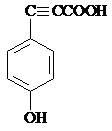 .
.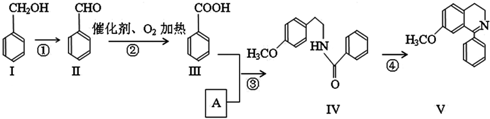
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2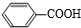
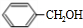 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O
+H2O
 .
.
 .
.