题目内容
7.下列说法或表示方法正确的是( )| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3kJ | |
| C. | 300℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | 由C(石墨)=C(金刚石)△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 |
分析 A.硫蒸气变化为硫固体为放热过程;
B.醋酸是弱酸,电离需要吸热;
C.可逆反应中,反应物不可能全部转化,0.5molN2(g)和1.5mol H2(g)并没有完全转化;
D.吸热反应是反应物能量低,生成物能量高,能量越低越稳定.
解答 解:A.硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,即前者放出热量多,故A错误;
B.醋酸是弱酸,电离需要吸热,所以1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3kJ,故B正确;
C.可逆反应中,反应物不可能全部转化,0.5molN2(g)和1.5mol H2(g)并没有完全转化,如果知道此时氮气的转化率,根据实际放热19.3kJ,才可以求得1mol氮气与3mol氢气完全转化成2mol氨气的反应热,故C错误;
D.由C(石墨)=C(金刚石)△H=+1.90 kJ/mol可知石墨的能量比金刚石的能量低,能量越低越稳定,所以石墨比金刚石稳定,故D错误;
故选B.
点评 本题考查了化学反应中的能量变化,中和热的判断,热化学方程式的含义,物质稳定性的判断,属于基础知识的考查,注意C选项易错,题目难度不大.

练习册系列答案
相关题目
14.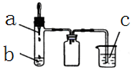 利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
 利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
利用如图所示装置进行下列实验,实验现象与结论均正确的是( )| 选项 | 实验试剂 | 实验现象 | 实验结论 | ||
| a | b | c | |||
| A | 浓氨水 | 碱石灰 | FeCl2溶液 | 产生白色沉淀,迅速变为灰绿色,最后变为红褐色 | 氨气具有氧化性 |
| B | 稀硫酸 | FeS | AgCl悬浊液 | 悬浊液由白色变为黑色 | Ksp(AgCl)>Ksp(Ag2S) |
| C | 浓硝酸 | 铜 | BaSO3悬浊液 | 悬浊液变澄清 | +4价硫具有还原性 |
| D | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
15.已知氮原子的质量数为14,则在NH3D+中,电子数、质子数、中子数之比为( )
| A. | 10:7:11 | B. | 11:11:8 | C. | 11:10:8 | D. | 10:11:8 |
2.表给出了14种元素的电负性.
已知:两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键.
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化;.
(2)判断下列物质是离子化合物还是共价化合物.
Mg3N2:离子化合物;BeCl2:共价化合物;AlCl3:共价化合物;SiC:共价化合物.
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化;.
(2)判断下列物质是离子化合物还是共价化合物.
Mg3N2:离子化合物;BeCl2:共价化合物;AlCl3:共价化合物;SiC:共价化合物.
12.下列说法不正确的是( )
| A. | 纯碱不是碱 | B. | 甘油不是油 | C. | 双氧水不是水 | D. | 醋酸不是酸 |
 工业上,可以由下列反应合成三聚氰胺:
工业上,可以由下列反应合成三聚氰胺: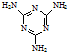 .其中氮原子的杂化方式有sp2、sp3.
.其中氮原子的杂化方式有sp2、sp3.