题目内容
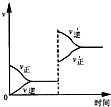 若平衡体系A+B═C+D,增大压强时反应速率变化如图所示.则下列关于各物质状态的说法正确的是( )
若平衡体系A+B═C+D,增大压强时反应速率变化如图所示.则下列关于各物质状态的说法正确的是( )| A、A、B、C、D都是气体 |
| B、C、D都是气体,A、B中有一种是气体 |
| C、A、B都不是气体,C、D中有一种是气体 |
| D、A、B都是气体,C、D中有一种是气体 |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:依据图象分析可知,增大压强正逆反应速率都增大,平衡逆向进行,说明反应前后都有气体,且正反应为气体体积增大的反应,结合平衡移动原理分析判断选项;
解答:
解:图象分析可知,增大压强正逆反应速率都增大,平衡逆向进行,说明反应前后都有气体,且正反应为气体体积增大的反应;
A、A、B、C、D都是气体时,反应前后气体体积不变,增大压强平衡不动,不符合图象变化,故A错误;
B、C、D都是气体,A、B中有一种是气体,符合反应前后气体体积增大,增大压强平衡逆向进行,正逆反应速率都增大,故B正确;
C、A、B都不是气体,C、D中有一种是气体,增大压强平衡逆向进行,但正反应速率应从原平衡点变化,故C错误;
D、A、B都是气体,C、D中有一种是气体,增大压强平衡正向进行,不符合图象变化,故D错误;
故选B.
A、A、B、C、D都是气体时,反应前后气体体积不变,增大压强平衡不动,不符合图象变化,故A错误;
B、C、D都是气体,A、B中有一种是气体,符合反应前后气体体积增大,增大压强平衡逆向进行,正逆反应速率都增大,故B正确;
C、A、B都不是气体,C、D中有一种是气体,增大压强平衡逆向进行,但正反应速率应从原平衡点变化,故C错误;
D、A、B都是气体,C、D中有一种是气体,增大压强平衡正向进行,不符合图象变化,故D错误;
故选B.
点评:本题考查了化学平衡影响因素分析,平衡图象变化的分析方法,注意正逆反应速率变化特征,掌握基础是关键,题目难度中等.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
下列做法中不利于我们生存环境保护的是( )
| A、鼓励家庭生活垃圾分类收集 |
| B、发展“低碳经济”,减小火力发电占总发电量的比例 |
| C、严禁焚烧桔杆,降低空气中PM2.5的浓度 |
| D、用化工厂未“达标”排放的废水灌溉农田 |
X、Y、Z、W四种主族元素,若X的阳离子与Y的阴离子具有相同的电子层结构;W的阳离子的氧化性强于等电荷数的X阳离子的氧化性;Z阴离子半径大于等电荷数的Y的阴离子半径,下列说法不正确的是( )
| A、若W元素最高价氧化物对应的水化物为强碱,则X元素最高价氧化物对应的水化物不一定为强碱 |
| B、Y的氢化物比Z的氢化物更稳定 |
| C、原子序数:Z>X>Y>W |
| D、离子半径:Y>X |
实验室用固态不纯氯化钠(含少量Na2SO4杂质)制取纯净氯化钠固体.下列操作可供选用:
①逐滴加入稀盐酸,调节pH值为5;
②加热溶液蒸干;
③加蒸馏水溶解;
④加入稍过量的Na2CO3溶液;
⑤加入稍过量的BaCl2溶液;
⑥过滤.
上述实验操作的正确顺序应是( )
①逐滴加入稀盐酸,调节pH值为5;
②加热溶液蒸干;
③加蒸馏水溶解;
④加入稍过量的Na2CO3溶液;
⑤加入稍过量的BaCl2溶液;
⑥过滤.
上述实验操作的正确顺序应是( )
| A、①②⑤⑥③④ |
| B、③⑤④⑥①② |
| C、④③⑥⑤①② |
| D、④③⑤⑥②① |
下列关于有机物的说法正确的是( )
| A、糖类、油脂、蛋白质都是由C、H、O三种元素组成 |
| B、蔗糖与淀粉水解最终产物均为葡萄糖 |
| C、利用油脂在酸性条件下水解,可以制得甘油和肥皂 |
| D、蛋白质在酶等催化剂的作用下水解生成氨基酸 |
 存在,且不与H原子直接相连.燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量.
存在,且不与H原子直接相连.燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量.