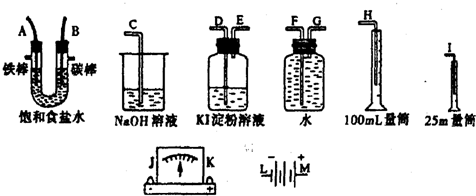
题目内容
15.将铁片、铜片用导线连接后,置于稀硫酸中,形成原电池,其正极反应式2H++2e-=H2↑;负极反应式Zn-2e-=Zn2+;
总反应方程式Zn+2H+=Zn2++H2↑.
分析 将铁片、铜片用导线连接后,置于稀硫酸中,形成原电池,原电池中锌是负极,铜是正极,正极上氢离子得电子生成氢气2H++2e-=H2↑,发生还原反应;负极上是金属锌失电子的氧化反应Zn-2e-=Zn2+,总反应等于正负极反应之和.
解答 解:将铁片、铜片用导线连接后,置于稀硫酸中,形成原电池,原电池中锌是负极,铜是正极,正极上氢离子得电子生成氢气,电极反应式为:2H++2e-=H2↑,发生还原反应;负极上是金属锌失电子的氧化反应,电极反应式为:Zn-2e-=Zn2+,总反应等于正负极反应之和,即Zn+2H+=Zn2++H2↑,故答案为:2H++2e-=H2↑;Zn-2e-=Zn2+;Zn+2H+=Zn2++H2↑.
点评 本题考查了原电池的反应原理的应用,电极反应、电极判断,题目较简单,注意基本知识的梳理和掌握.

练习册系列答案
相关题目
5.现有下列三个图象:下列反应中符合下述全部图象的反应是( )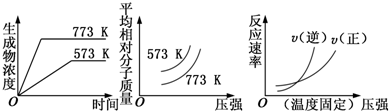

| A. | N2(g)+3H2(g)═2NH3(g)△H<0 | B. | 2SO3(g)?═?2SO2(g)+O2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0 | D. | H2(g)+CO(g)?═?C(s)+H2O(g)△H>0 |
6.化学与生产和生活密切相关,下列说法正确的是( )
| A. | 汽油、花生油都是油脂 | |
| B. | 碘元素遇淀粉溶液变蓝色 | |
| C. | 合成纤维、玻璃纤维和光导纤维都是有机高分子化合物 | |
| D. | 铵态氮肥不能与草木灰混合施用 |
3.实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程,Fe3+在pH=5时已完全沉淀.其分析错误的是( )


| A. | 洗涤晶体:向滤出晶体的漏斗中加少量冷水浸没晶体,自然流下,重复2-3次 | |
| B. | 用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种 | |
| C. | 利用Cu(OH)2替代CuO也可调试溶液pH,不影响实验结果 | |
| D. | 若要测定所得硫酸铜晶体中结晶水的数目,在实验中要用到坩埚和坩埚钳 |
10.下列关于“化学与健康”的说法不正确的是( )
| A. | 服用铬含量超标的药用胶囊会对人对健康造成危害 | |
| B. | 食用一定量的油脂能促进人体对某些维生素的吸收 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 使用填埋法处理未经分类的生活垃圾 |
7.硝酸与金属反应往往产生氮氧化物,但是在某些特殊情况则不然.将稀硝酸(HNO3浓度低于2mol•L-1)与过量金属镁缓和反应放出气体A,反应完全后向剩余溶液中加入过量NaOH固体并加热,放出气体B,将两次放出气体全部收集并混合,用碱石灰干燥后缓慢通过足量的灼热氧化铜固体,观察到固体变红,将剩余气体用浓硫酸干燥,气体体积变为原来的三分之一,则下列分析不正确的是(本题中所有气体体积均为相同条件下测得的体积)( )
| A. | 灼热氧化铜变红过程发生的反应有2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu | |
| B. | 气体A为H2;气体B为NH3 | |
| C. | 气体A与气体B的体积比为1:2 | |
| D. | 在镁与硝酸反应过程中还原剂与氧化剂的物质的量之比为3:2 |
4.关于化学式[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是( )
| A. | 配位体是Cl-和H2O,配位数是8 | |
| B. | 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ | |
| C. | 内界和外界中的Cl-的数目比是1:2 | |
| D. | 在1mol该配合物中加入足量AgNO3溶液,可以得到3molAgCl沉淀 |