题目内容
请按要求回答下列问题:
(1)用离子方程式表示明矾净水的原因: ;
(2)请写出H2SO3的电离方程式: ;
(3)用离子方程式表示泡沫灭火器〔内有Al2(SO4)3和NaHCO3溶液〕的使用原理: ;
(4)羟基的电子式是 ;
(5)烃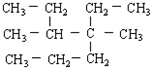 的正确系统命名为 .
的正确系统命名为 .
(1)用离子方程式表示明矾净水的原因:
(2)请写出H2SO3的电离方程式:
(3)用离子方程式表示泡沫灭火器〔内有Al2(SO4)3和NaHCO3溶液〕的使用原理:
(4)羟基的电子式是
(5)烃
 的正确系统命名为
的正确系统命名为考点:盐类水解的应用,电子式,电离方程式的书写,有机化合物命名
专题:化学用语专题
分析:(1)明矾水解生成具有吸附性的氢氧化铝胶体;
(2)亚硫酸是多元弱酸分步电离,用可逆号表示;
(3)Al2(SO4)3溶液与NaHCO3溶液发生互促水解生成Al(OH)3和CO2;
(4)根据电子式的书写规则写出电子式;
(5)根据烷烃的命名原则命名.
(2)亚硫酸是多元弱酸分步电离,用可逆号表示;
(3)Al2(SO4)3溶液与NaHCO3溶液发生互促水解生成Al(OH)3和CO2;
(4)根据电子式的书写规则写出电子式;
(5)根据烷烃的命名原则命名.
解答:
解:(1)明矾水解生成氢氧化铝胶体,具有吸附性,反应的离子方程式为Al3++3H2O?Al(OH)3(胶体)+3H+,
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;
(2)亚硫酸是多元弱酸分步电离,电离离子方程式为:H2SO3?H++HSO3-、HSO3-?H++SO32-,
故答案为:H2SO3?H++HSO3-、HSO3-?H++SO32-;
(3)Al2(SO4)3溶液水解成酸性,NaHCO3溶液水解成碱性,二者发生互促水解生成Al(OH)3和CO2,反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)羟基中氧原子与氢原子共用一对电子,电子式为: ,故答案为:
,故答案为: ;
;
(5)根据烷烃的命名原则: 的名称为:3,4-二甲基-4-乙基庚烷,
的名称为:3,4-二甲基-4-乙基庚烷,
故答案为:3,4-二甲基-4-乙基庚烷.
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;
(2)亚硫酸是多元弱酸分步电离,电离离子方程式为:H2SO3?H++HSO3-、HSO3-?H++SO32-,
故答案为:H2SO3?H++HSO3-、HSO3-?H++SO32-;
(3)Al2(SO4)3溶液水解成酸性,NaHCO3溶液水解成碱性,二者发生互促水解生成Al(OH)3和CO2,反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)羟基中氧原子与氢原子共用一对电子,电子式为:
 ,故答案为:
,故答案为: ;
;(5)根据烷烃的命名原则:
 的名称为:3,4-二甲基-4-乙基庚烷,
的名称为:3,4-二甲基-4-乙基庚烷,故答案为:3,4-二甲基-4-乙基庚烷.
点评:本题考查了盐类水解的应用,常用化学用语的书写,题目难度不大,注意多元弱酸分部电离.

练习册系列答案
相关题目
下列关于元素周期表的说法不正确的是( )
| A、元素周期表中一共有18个纵行 |
| B、原子最外层电子数为2的元素全部位于周期表的第ⅡA族和零族 |
| C、同周期第ⅡA族与第ⅢA族元素的原子序数之差可能为25 |
| D、同主族两种元素的原子序数之差可能为44 |
将一小块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体粉末,下列有关叙述不正确的是( )
| A、表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠 |
| B、“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液 |
| C、最后变成的白色固体粉末是碳酸钠 |
| D、该过程的所有化学反应均为化合反应 |
下列有关胶体的说法正确的是( )
| A、胶体一定是混合物 |
| B、胶体与溶液的本质区别是有丁达尔效应 |
| C、将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 |
| D、胶体稳定的原因是因为胶体带电 |
 乙醇分子中的化学键如右图所示,在不同反应中断键不同:
乙醇分子中的化学键如右图所示,在不同反应中断键不同: