题目内容
A、B、C、D四种溶液分别是NaOH溶液、氨水、CH3COOH溶液、盐酸中的一种.常温下:
①浓度均为0.1mol?L-1的A和C溶液,pH:A<C<7;
②将1L pH=3的A溶液分别与0.001mol?L-1xL B溶液、0.001mol?L-1yL D溶液充分反应至中性,x、y大小关系为:y<x;回答下列问题:
(1)D是 (填化学式)溶液;
(2)②中1LpH=3的A溶液与0.001mol?L-1 xL B溶液充分反应至中性,所得溶液中各种离子的物质的量浓度由大到小的顺序为 .
(3)常温下,等体积且等物质的量浓度的C溶液和D溶液充分混合后所得溶液的pH 7(填“>”、“<”或“=”),用离子方程式解释其原因 .
(4)向pH相同且等体积的两份溶液A和C中,分别投入质量不同的锌粉反应,若放出氢气的质量相同,则下列说法正确的是 (填写序号).
①开始反应时的速率A>C ②反应所需要的时间C>A
③参加反应的锌粉物质的量A=C ④A溶液里有锌粉剩余.
①浓度均为0.1mol?L-1的A和C溶液,pH:A<C<7;
②将1L pH=3的A溶液分别与0.001mol?L-1xL B溶液、0.001mol?L-1yL D溶液充分反应至中性,x、y大小关系为:y<x;回答下列问题:
(1)D是
(2)②中1LpH=3的A溶液与0.001mol?L-1 xL B溶液充分反应至中性,所得溶液中各种离子的物质的量浓度由大到小的顺序为
(3)常温下,等体积且等物质的量浓度的C溶液和D溶液充分混合后所得溶液的pH
(4)向pH相同且等体积的两份溶液A和C中,分别投入质量不同的锌粉反应,若放出氢气的质量相同,则下列说法正确的是
①开始反应时的速率A>C ②反应所需要的时间C>A
③参加反应的锌粉物质的量A=C ④A溶液里有锌粉剩余.
考点:弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:①浓度均为0.1mol?L-1的A和C溶液,pH:A<C<7,说明A、C都是酸,且A的酸性大于C,所以A是盐酸、C是醋酸;
②将1LpH=3的A溶液分别与0.001mol?L-1xL B溶液、0.001mol?L-1yL D溶液充分反应至中性,x、y大小关系为:y<x,说明B是B是氨水、D是NaOH.
②将1LpH=3的A溶液分别与0.001mol?L-1xL B溶液、0.001mol?L-1yL D溶液充分反应至中性,x、y大小关系为:y<x,说明B是B是氨水、D是NaOH.
解答:
解:①浓度均为0.1mol?L-1的A和C溶液,pH:A<C<7,说明A、C都是酸,且A的酸性大于C,所以A是盐酸、C是醋酸;
②将1LpH=3的A溶液分别与0.001mol?L-1xL B溶液、0.001mol?L-1yL D溶液充分反应至中性,x、y大小关系为:y<x,说明B是B是氨水、D是NaOH,
(1)通过以上分析知,D是NaOH,故答案为:NaOH;
(2)②中1LpH=3的A溶液与0.001mol?L-1 xL B溶液充分反应至中性,则c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(Cl-),盐溶液中氢离子和氢氧根离子浓度很小,所以离子浓度大小顺序是c(NH4+)=c(Cl-)>c(H+)=c(OH-),故答案为:c(NH4+)=c(Cl-)>c(H+)=c(OH-);
(3)常温下,等体积且等物质的量浓度的C溶液和D溶液充分混合后,溶液中的溶质是醋酸钠,醋酸钠为强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,则pH>7,水解离子方程式为,故答案为:>;CH3COO-+H2O?CH3COOH+OH-;
(4)①反应速率与氢离子浓度成正比,开始时氢离子浓度 相等,所以开始反应时的速率A=C,故错误;
②随着反应的进行,醋酸中氢离子浓度大于盐酸,所以醋酸反应速率大于盐酸,则反应所需要的时间C<A,故错误;
③生成氢气的量相同,根据转移电子相同知,参加反应的锌粉物质的量A=C,故正确;
④醋酸的浓度大于盐酸,二者体积相等时,醋酸的物质的量大于盐酸,所以A溶液里有锌粉剩余,故正确;
故选③④.
②将1LpH=3的A溶液分别与0.001mol?L-1xL B溶液、0.001mol?L-1yL D溶液充分反应至中性,x、y大小关系为:y<x,说明B是B是氨水、D是NaOH,
(1)通过以上分析知,D是NaOH,故答案为:NaOH;
(2)②中1LpH=3的A溶液与0.001mol?L-1 xL B溶液充分反应至中性,则c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(Cl-),盐溶液中氢离子和氢氧根离子浓度很小,所以离子浓度大小顺序是c(NH4+)=c(Cl-)>c(H+)=c(OH-),故答案为:c(NH4+)=c(Cl-)>c(H+)=c(OH-);
(3)常温下,等体积且等物质的量浓度的C溶液和D溶液充分混合后,溶液中的溶质是醋酸钠,醋酸钠为强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,则pH>7,水解离子方程式为,故答案为:>;CH3COO-+H2O?CH3COOH+OH-;
(4)①反应速率与氢离子浓度成正比,开始时氢离子浓度 相等,所以开始反应时的速率A=C,故错误;
②随着反应的进行,醋酸中氢离子浓度大于盐酸,所以醋酸反应速率大于盐酸,则反应所需要的时间C<A,故错误;
③生成氢气的量相同,根据转移电子相同知,参加反应的锌粉物质的量A=C,故正确;
④醋酸的浓度大于盐酸,二者体积相等时,醋酸的物质的量大于盐酸,所以A溶液里有锌粉剩余,故正确;
故选③④.
点评:本题考查了弱电解质的电离,明确弱电解质的电离特点是解本题关键,知道不同酸与同一金属反应时,反应速率与氢离子浓度成正比,与酸的物质的量、酸的强弱无关,再结合盐类水解解答.

练习册系列答案
相关题目
汽车尾气(含有烃类、CO、NOx、SO2)是城市空气的主要污染源,治理方法之一是在汽车排气管上加装“催化转化器”,它使CO和NOx反应生成可参与大气生态环境循环的无毒气体,并使烃类充分燃烧及SO2转化,下列说法错误的是( )
| A、CO和NOx反应的化学方程式为:2xCO+2NOx=2xCO2+N2 |
| B、上述方法的缺点是由于CO2增多,会大大提高空气的酸度 |
| C、多植树造林,增大绿化面积,可有效控制城市空气各种污染源 |
| D、汽车改用天然气为燃料或开发氢能源,都会减少对空气的污染 |
下列物质分类正确的是( )
| A、SO2、CO2、CO均为酸性氧化物 |
| B、稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C、烧碱、纯醋酸、四氯化碳均为电解质 |
| D、空气、混凝土、氨水均为混合物 |
下列离子方程式书写正确的是( )
| A、AlCl3溶液与过量的氨水反应:Al3++3OH-=Al(OH)3↓ |
| B、工业上用NO2与水反应制取HNO3:3NO2+H2O═NO3-+NO+2H+ |
| C、碳酸氢钠溶液与稀硫酸反应:HCO3-+H+=CO2↑+H2O |
| D、硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓ |
 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)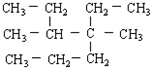 的正确系统命名为
的正确系统命名为