题目内容
1.下列各组离子能在溶液中大量共存,且溶液无色的是( )| A. | K+、Cl-、NO3-、CO32- | B. | Ag+、K+、Cl-、NO3- | ||
| C. | Cu2+、SO42-、Na+、CO32- | D. | Ba2+、OH-、Mg2+、NO3- |
分析 无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.四种离子之间不反应,都是无色离子;
B.银离子与氯离子反应生成氯化银沉淀;
C.铜离子为有色离子,铜离子与碳酸根离子反应;
D.镁离子与氢氧根离子反应生成氢氧化镁沉淀.
解答 解:无色溶液可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在
A.K+、Cl-、NO3-、CO32-之间不反应,都是无色离子,在溶液中能够大量共存,故A正确;
B.Ag+、Cl-之间反应生成难溶物氯化银,在溶液中不能大量共存,故B错误;
C.Cu2+为有色离子,Cu2+、CO32-之间发生反应,在溶液中不能大量共存,故C错误;
D.OH-、Mg2+之间反应生成难溶物氢氧化镁,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的颜色,无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
12.下列对HCl、Cl2、H2O、NH3、CH4这组分子中共价键形成方式的分析正确的是( )
| A. | 都是σ键,没有π键 | B. | 都是π键,没有σ键 | C. | 既有π键,又有σ键 | D. | 除CH4外,都是σ键 |
9.人体内所必需的下列元素中,因摄入量不足而贫血的是( )
| A. | K | B. | Ca | C. | Na | D. | Fe |
16.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH$\frac{\underline{\;0-30℃\;}}{\;}$2K2FeO4+6KCl+8H2O.下列有关该反应说法正确的是( )
| A. | 钾元素化合价降低 | B. | Fe(OH)3发生氧化反应 | ||
| C. | 该反应是置换反应 | D. | Cl2是还原剂 |
6.下列离子方程式,书写正确的是( )
| A. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| C. | 硝酸银溶液中加入铜粉:2Ag++Cu═Cu2++2Ag↓ | |
| D. | 盐酸跟氢氧化镁反应:H++OH-═H2O |
13.下列各组中的两种物质在溶液中的反应/可用同一离子方程式表示的是( )
| A. | Ba(OH)2 和盐酸;Ba(OH)2和 H2SO4 | |
| B. | BaCl2和Na2SO4;Ba(OH)2和(NH4)2SO4 | |
| C. | Ca(OH)2溶液通过量CO2; NaOH溶液通过量CO2 | |
| D. | Ba(OH)2和 HNO3; Cu (OH)2和 H2SO4 |
10.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是( )
| A. | 35Cl原子所含质子数为18 | |
| B. | 1mol的1H35Cl分子所含中子数为18个 | |
| C. | 7g的35Cl2气体的体积为2.24L | |
| D. | 35Cl2气体的摩尔质量为70g/mol |
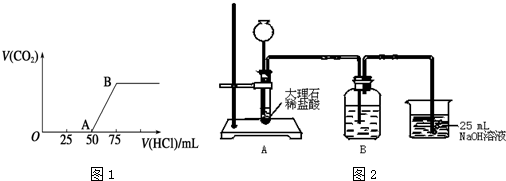
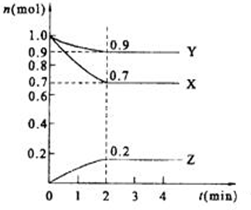 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.