题目内容
若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,可能大量共存的是( )
| A、NH4+ NO3- CO32- Na+ |
| B、Na+ Ba2+ Mg2+ HCO3- |
| C、Cu2+ Fe3+ K+ Cl- |
| D、NO3- K+ AlO2- H+ |
考点:离子共存问题
专题:离子反应专题
分析:加入铝粉能放出氢气的溶液中,为非氧化性酸或强碱溶液,根据离子之间不能结合生成沉淀,气体、水等,不能发生氧化还原反应,则离子大量共存,以此来解答.
解答:
解:加入铝粉能放出氢气的溶液中,为非氧化性酸或强碱溶液,则
A.碱溶液中不能大量存在NH4+,酸溶液中不能大量存在CO32-,故A不选;
B.碱溶液中不能大量存在Mg2+、HCO3-,酸溶液中不能大量存在HCO3-,故B不选;
C.酸溶液中该组离子之间不反应,可大量共存,故C选;
D.AlO2-、H+结合生成沉淀,不能共存,碱溶液中不能大量存在H+,酸溶液中不能大量存在AlO2-,且Al、NO3-、H+发生氧化还原反应,不能共存,故D不选;
故选C.
A.碱溶液中不能大量存在NH4+,酸溶液中不能大量存在CO32-,故A不选;
B.碱溶液中不能大量存在Mg2+、HCO3-,酸溶液中不能大量存在HCO3-,故B不选;
C.酸溶液中该组离子之间不反应,可大量共存,故C选;
D.AlO2-、H+结合生成沉淀,不能共存,碱溶液中不能大量存在H+,酸溶液中不能大量存在AlO2-,且Al、NO3-、H+发生氧化还原反应,不能共存,故D不选;
故选C.
点评:本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
下列各组物质中,化学键的类型(离子键、共价键)相同的是( )
| A、CO和MgCl2 |
| B、NH4F和NaF |
| C、Na2O2和H2O2 |
| D、H2O和SO2 |
水的电离过程为H2O?H++OH-,下列叙述正确的是( )
| A、升高温度,促进水的电离,c(H+)增大,PH增大 |
| B、加入NaOH,抑制水的电离,c(H+)和c(OH-)都减小 |
| C、加入NH4Cl,促进水的电离,溶液呈碱性 |
| D、Kw只与温度有关 |
下列方程式书写正确的是( )
| A、向小苏打溶液中加入NaAlO2:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- |
| B、碳酸氢钠溶液跟过量的饱和石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
| C、NaHSO4溶液中滴入少量Ba(OH)2:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D、200mL2mol/LFeBr2溶液中通入11.2L标况下的Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-? |
已知反应A2(g)+2B(s)?A2B2(g)△H<0,下列说法正确的是( )
| A、升高温度,化学平衡向正反应方向移动 |
| B、增大压强,正反应与逆反应速率均增大 |
| C、增大压强,化学平衡向正反应方向移动 |
| D、增大B的物质的量,化学平衡向正反应方向移动 |
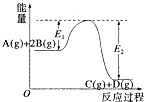 反应A(g)+2B(g)?C(g)+D(g)+QkJ过程中的能量变化如图所示,有关叙述正确的是( )
反应A(g)+2B(g)?C(g)+D(g)+QkJ过程中的能量变化如图所示,有关叙述正确的是( )| A、Q=E2 |
| B、在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 |
| C、Q>0,仅升高温度,当反应再次达到平衡时,A的平衡浓度增大 |
| D、1molA(g)和2molB(g)具有的能量比1molC(g)和1molD(g)具有的能量低 |
下列离子方程式与所述事实相符且正确的是( )
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B、用过氧化钠与H2O反应制取氧气:2Na2O2+2H2O=4Na++4OH-+O2↑ |
| C、向NaAlO2 溶液中通入过量的CO2 制取Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| D、在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |