题目内容
8.工业上可以利用水煤气(H2、CO)合成二甲醚(CH3OCH3),同时生成CO2.2H2(g)+CO(g)═CH3OH(g)△H=-91.8kJ/mol
2CH3OH(g)═CH3OCH3 (g)+H2O(g)△H=-23.5kJ/mol
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.3kJ/mol
下列说法不正确的是( )
| A. | 二甲醚与乙醇互为同分异构体 | |
| B. | CH3OCH3中只含有极性共价键 | |
| C. | CH3OH和乙醇均可发生消去反应 | |
| D. | 水煤气合成二甲醚的热化学方程式:3H2(g)+3CO(g)═CH3OCH3 (g)+CO2(g)△H=-248.4kJ/mol |
分析 A、分子式相同而结构不同的化合物互为同分异构体;
B、形成于不同种原子之间的共价键为极性共价键;
C、当-OH所在碳原子的相邻碳原子上有H原子时,此种醇能发生消去反应;
D、根据目标反应,通过对所给反应运用盖斯定律来分析.
解答 解:A、分子式相同而结构不同的化合物互为同分异构体,而二甲醚和乙醇的分子式相同而结构不同,故互为同分异构体,故A正确;
B、形成于不同种原子之间的共价键为极性共价键,而CH3OCH3中存在的键为C-H键、C-O键,均为极性共价键,故B正确;
C、当-OH所在碳原子的相邻碳原子上有H原子时,此种醇能发生消去反应,故乙醇可以发生消去反应,但甲醇不能,故C错误;
D、已知反应:①2H2(g)+CO(g)═CH3OH(g)△H=-91.8kJ/mol
②2CH3OH(g)═CH3OCH3 (g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.3kJ/mol
根据盖斯定律可知,将①×2+②+③可得:3H2(g)+3CO(g)═CH3OCH3 (g)+CO2(g)△H=(-91.8kJ/mol)×2+(-23.5kJ/mol)+(-41.3kJ/mol)=-248.4kJ/mol,故D正确.
故选C.
点评 本题考查了盖斯定律的应用、同分异构体的判断和共价键的分类,难度不大,应注意醇发生消去反应对结构的要求.

练习册系列答案
相关题目
9.下列属于电解质的是( )
| A. | 蔗糖 | B. | 二氧化硫 | C. | 水 | D. | 镁条 |
19.CO2通入下列溶液中,不可能产生沉淀的是( )
| A. | 饱和Na2CO3溶液 | B. | 石灰水 | C. | CaCl2溶液 | D. | Ba(OH)2溶液 |
16.下列离子方程式中,不正确的是( )
| A. | 用NaOH溶液除去铝箔表面的氧化膜 Al2O3+2OH-═2AlO2-+H2O | |
| B. | 向AlCl3溶液中加入过量氨水 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用胃舒平(复方氢氧化铝)缓解胃酸(HCl)过多 OH-+H+═H2O | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体Al3++3H2O?Al(OH)3 (胶体)+3H+ |
3.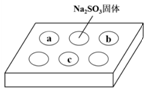 某同学进行SO2的性质实验.在点滴板a、b、c处分别滴有不同的试剂,再向Na2S
某同学进行SO2的性质实验.在点滴板a、b、c处分别滴有不同的试剂,再向Na2S
O3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如表所示.下列说法正确的是( )
 某同学进行SO2的性质实验.在点滴板a、b、c处分别滴有不同的试剂,再向Na2S
某同学进行SO2的性质实验.在点滴板a、b、c处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如表所示.下列说法正确的是( )
| 序号 | 试剂 | 实验现象 |
| a | 品红溶液 | 红色褪去 |
| b | 酸性KMnO4溶液 | 紫色褪去 |
| c | NaOH溶液(含2滴酚酞) | 红色褪去 |
| A. | 浓硫酸与Na2SO3固体发生了氧化还原反应 | |
| B. | a、b均表明SO2具有漂白性 | |
| C. | c中只可能发生反应:SO2+2OH-═SO32-+H2O | |
| D. | c中所得溶液的离子浓度一定存在关系:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-) |
13.下列措施或事实不能用勒沙特列原理解释的是( )
| A. | 滴加酚酞的氨水中加入氯化铵固体后红色变浅 | |
| B. | 棕红色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)?N2O4 (g)) | |
| C. | 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 | |
| D. | 用硫酸氢钠去除暖水瓶中的水垢 |
20.目前世界上用量最大,用途最广的合金是( )
| A. | 铝合金 | B. | 青铜 | C. | 钢铁 | D. | 塑钢 |
18.下列关于证明醋酸是弱电解质的实验方法不正确的是( )
| A. | 常温下,测定0.1mol•L-1CH3COOH的pH值,若pH大于1,即可证明为弱电解质 | |
| B. | 等体积的0.1mol•L-1HCl和0.1mol•L-1醋酸溶液,分别与等量的相同颗粒度的Zn反应,观察产生气泡的速率,即可证明 | |
| C. | 等体积的0.1mol•L-1HCl和 0.1mol•L-1醋酸溶液,比较中和这两种酸所需相同物质的量浓度的NaOH溶液的体积,即可证明 | |
| D. | 常温下,测一定浓度的CH3COONa溶液的pH值,若pH大于7,即可证明 |
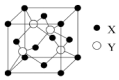 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层电子数的3倍;元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层电子数的3倍;元素W基态原子的核外电子共有16种运动状态.