题目内容
13.下列措施或事实不能用勒沙特列原理解释的是( )| A. | 滴加酚酞的氨水中加入氯化铵固体后红色变浅 | |
| B. | 棕红色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)?N2O4 (g)) | |
| C. | 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 | |
| D. | 用硫酸氢钠去除暖水瓶中的水垢 |
分析 勒沙特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.勒沙特列原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用勒沙特列原理解释.
解答 解:A.因为氨水中存在一水合氨的电离平衡,向滴加酚酞的氨水中加入氯化铵,铵根离子浓度增大,抑制一水合氨的电离,氢氧根离子浓度降低,溶液颜色变浅,能用勒夏特列原理解释,故A不选;
B.加压二氧化氮的浓度增大,平衡向生成四氧化二氮的方向移动,故加压后颜色先变深后变浅,但仍比原来的颜色深,可以勒夏特列原理解释,故B不选;
C.工业上生产硫酸的过程中,使用过量的空气,平衡正向移动,提高SO2的利用率,所以能用勒夏特里原理解释,故C不选;
D.硫酸氢钠溶液呈酸性与碳酸钙发生复分解反应,生成二氧化碳,不符合平衡移动的原理,故D选;
故选D.
点评 本题考查化学平衡移动的原理,学生只要掌握外界条件的改变,对化学平衡移动的影响结果,就能迅速解题了.

练习册系列答案
相关题目
1.下列关于Mg(OH)2制备和性质的离子方程式,不正确的是( )
| A. | 由MgCl2溶液和NaOH溶液制备Mg(OH)2:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 向Mg(OH)2悬浊液中滴加浓FeCl3溶液,生成红褐色沉淀:3Mg(OH)2 (s)+2Fe3+═2Fe(OH)3(s)+3Mg2+ | |
| C. | 向Mg(OH)2悬浊液中滴加浓NH4Cl溶液,浊液变澄清:Mg(OH)2+2NH4+═2NH3•H2O+Mg2+ | |
| D. | 向Mg(OH)2悬浊液中滴加醋酸,浊液变澄清:Mg(OH)2+2H+═Mg2++2H2O |
8.工业上可以利用水煤气(H2、CO)合成二甲醚(CH3OCH3),同时生成CO2.
2H2(g)+CO(g)═CH3OH(g)△H=-91.8kJ/mol
2CH3OH(g)═CH3OCH3 (g)+H2O(g)△H=-23.5kJ/mol
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.3kJ/mol
下列说法不正确的是( )
2H2(g)+CO(g)═CH3OH(g)△H=-91.8kJ/mol
2CH3OH(g)═CH3OCH3 (g)+H2O(g)△H=-23.5kJ/mol
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.3kJ/mol
下列说法不正确的是( )
| A. | 二甲醚与乙醇互为同分异构体 | |
| B. | CH3OCH3中只含有极性共价键 | |
| C. | CH3OH和乙醇均可发生消去反应 | |
| D. | 水煤气合成二甲醚的热化学方程式:3H2(g)+3CO(g)═CH3OCH3 (g)+CO2(g)△H=-248.4kJ/mol |
18.下面提到的问题中,与盐的水解有关的是( )
①明矾和FeCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
④在NH4Cl溶液中加入金属镁会产生氢气.
①明矾和FeCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
④在NH4Cl溶液中加入金属镁会产生氢气.
| A. | ①③④ | B. | ②③ | C. | 全部 | D. | ①②④ |
5.某物质的年产量可以用来衡量一个国家的石油化工发展水平,该物质是( )
| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 甲苯 |
2.下面的排序不正确的是( )
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 晶格能由大到小:NaF>NaCl>NaBr>NaI | |
| D. | 熔点由高到低:Na>Mg>Al |
3.下列说法正确的是( )
| A. | 常温下可用铁制或铝制容器盛装浓硝酸 | |
| B. | 高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁 | |
| C. | SO2气体可使酸性高锰酸钾溶液褪色,体现了SO2的漂白性 | |
| D. | 二氧化碳和二氧化硅都是酸性氧化物,都能与水反应生成相应的酸 |
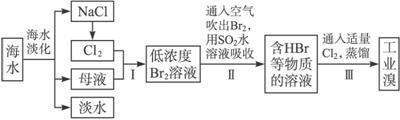
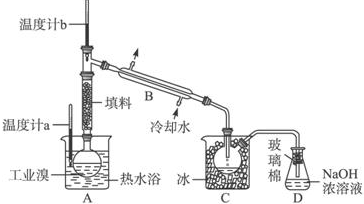

 .
. .
.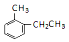 的名称是2-甲基乙苯.
的名称是2-甲基乙苯. +CH3COOH$?_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.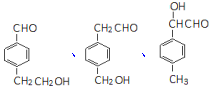 任一种.
任一种.