��Ŀ����
3�� ijͬѧ����SO2������ʵ�飮�ڵ�ΰ�a��b��c���ֱ���в�ͬ���Լ�������Na2S
ijͬѧ����SO2������ʵ�飮�ڵ�ΰ�a��b��c���ֱ���в�ͬ���Լ�������Na2SO3�����ϵμ�����ŨH2SO4����������ΰ��ϸ���������һ��ʱ���۲쵽��ʵ�����������ʾ������˵����ȷ���ǣ�������
| ��� | �Լ� | ʵ������ |
| a | Ʒ����Һ | ��ɫ��ȥ |
| b | ����KMnO4��Һ | ��ɫ��ȥ |
| c | NaOH��Һ����2�η�̪�� | ��ɫ��ȥ |
| A�� | Ũ������Na2SO3���巢����������ԭ��Ӧ | |
| B�� | a��b������SO2����Ư���� | |
| C�� | c��ֻ���ܷ�����Ӧ��SO2+2OH-�TSO32-+H2O | |
| D�� | c��������Һ������Ũ��һ�����ڹ�ϵ��c��Na+��+c��H+��=2c��SO32-��+c��HSO3-��+c��OH-�� |
���� A��Ũ������Na2SO3���巢�����������ƺͶ�������
B�������������������Ƿ���������ԭ����ɫ������������Ʒ���Ƕ��������Ư���ԣ�
C��Ҳ�����Ƕ��������Ư���ԣ�
D�����ݵ���غ�������
��� �⣺A��Ũ������Na2SO3���巢�����������ƺͶ��������Ƿ�������ԭ��Ӧ����A����
B�������������������Ƿ���������ԭ����ɫ������������Ʒ���Ƕ��������Ư���ԣ�����a��Ư���ԡ�b�ǻ�ԭ�ԣ���B����
C��Ҳ�����Ƕ��������Ư���ԣ�����c�к�ɫ��ȥ��ԭ�������������кͣ�Ҳ�����Ƕ��������Ư���ԣ���C����
D�����ݵ���غ㣬c��������Һ������Ũ��һ�����ڹ�ϵ��c��Na+��+c��H+��=2c��SO32-��+c��HSO3-��+c��OH-������D��ȷ��
��ѡD��
���� ���⿼�������������ʣ���Ŀ�ѶȲ������״���ΪC�ע���̪��ɫ��ԭ����������к�Ҳ�����Ƕ��������Ư���ԣ�

��ϰ��ϵ�д�
�����Ŀ
4����һ��10L���ܱ�����������ӦA��g��+B��g��?C��g��+D��g�������ƽ�ⳣ�����¶ȵĹ�ϵ�����
�ش��������⣺
��1����H�� 0���������������
��2��830��ʱ����һ��10L���ܱ������г���1mol��A��1mol��B����
�ٷ�Ӧ��ƽ��ʱ��n ��D��=0.5mol����A��ƽ��ת����Ϊ50%��
�ڸ��¶���ƽ�ⳣ��K=1��
��3���жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊad
a��c��A�����ٸı� b�����������ܶȲ��ٸı�
c����ϵ��ѹǿ���ٸı� d����λʱ��������C������D�����ʵ������
��4��1200��ʱ��ӦC��g��+D��g��?A��g��+B��g����ƽ�ⳣ��Ϊ2.5��
| �¶�/�� | 700 | 800 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | K | 0.6 | 0.4 |
��1����H�� 0���������������
��2��830��ʱ����һ��10L���ܱ������г���1mol��A��1mol��B����
�ٷ�Ӧ��ƽ��ʱ��n ��D��=0.5mol����A��ƽ��ת����Ϊ50%��
�ڸ��¶���ƽ�ⳣ��K=1��
��3���жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊad
a��c��A�����ٸı� b�����������ܶȲ��ٸı�
c����ϵ��ѹǿ���ٸı� d����λʱ��������C������D�����ʵ������
��4��1200��ʱ��ӦC��g��+D��g��?A��g��+B��g����ƽ�ⳣ��Ϊ2.5��
14����0.010 0mol•L-1�� NaOH ��Һ����Ũ��Ϊ0.010 0mol•L-1�����Ϊ20.00mL�� CH3COOH ��Һ���ڵμӹ�����n��CH3COOH�� ��n��CH3COO-�� ����Һ pH �ķֲ���ϵ��ͼ������˵������ȷ���ǣ�������

| A�� | pH=4 ʱ������ĵ��볣��Ka��1.8��10-5 | |
| B�� | B��ʱ��c��CH3COO����=c��CH3COOH�� | |
| C�� | B��ʱ������Һ�е����̪�Լ�����Һ�Ժ�ɫ | |
| D�� | C��ʱ��c��CH3COO������c��Na+����c��H+����c��OH�� |
18�������뺣ˮ��Դ�йص����������У�δ�漰������ԭ��Ӧ���ǣ�������
| A�� | ��ˮ���� | B�� | ������� | C�� | �ȼҵ | D�� | ��ˮɹ�� |
8����ҵ�Ͽ�������ˮú����H2��CO���ϳɶ����ѣ�CH3OCH3����ͬʱ����CO2��
2H2��g��+CO��g���TCH3OH��g����H=-91.8kJ/mol
2CH3OH��g���TCH3OCH3 ��g��+H2O��g����H=-23.5kJ/mol
CO��g��+H2O��g���TCO2��g��+H2��g����H=-41.3kJ/mol
����˵������ȷ���ǣ�������
2H2��g��+CO��g���TCH3OH��g����H=-91.8kJ/mol
2CH3OH��g���TCH3OCH3 ��g��+H2O��g����H=-23.5kJ/mol
CO��g��+H2O��g���TCO2��g��+H2��g����H=-41.3kJ/mol
����˵������ȷ���ǣ�������
| A�� | ���������Ҵ���Ϊͬ���칹�� | |
| B�� | CH3OCH3��ֻ���м��Թ��ۼ� | |
| C�� | CH3OH���Ҵ����ɷ�����ȥ��Ӧ | |
| D�� | ˮú���ϳɶ����ѵ��Ȼ�ѧ����ʽ��3H2��g��+3CO��g���TCH3OCH3 ��g��+CO2��g����H=-248.4kJ/mol |
15����ij������һҺ�����ʱ��ƽ��ʱ���ΪV1mL�����Ӷ���ΪV2ml�����Ӷ���ΪV3mL����V3��V1��V2������ʹ�õ����������ǣ�������
| A�� | ����ƿ | B�� | ��Ͳ | C�� | ��ʽ�ζ��� | D�� | ������������ |
13����A����B��Ӧ���ɷų�����C��C��NaOH��Ӧ����A��C���տ���������D��D����ˮ����B����A��B�ֱ��ǣ�������
| A�� | Na2S��HCl | B�� | Na2CO3��H2SO4 | C�� | NaHCO3��HCl | D�� | Na2SO3�� H2SO4 |
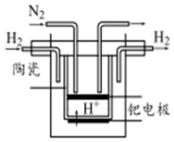 ���Ĺ̶��Թ�ũҵ��������������ش����壮
���Ĺ̶��Թ�ũҵ��������������ش����壮 ��
��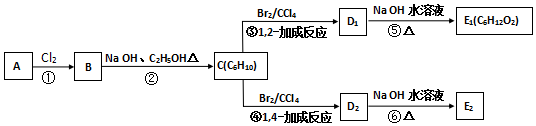
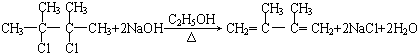 ��C�Ļ�ѧ����Ϊ2��3-����-1��3-����ϩ��E2�Ľṹ��ʽ��
��C�Ļ�ѧ����Ϊ2��3-����-1��3-����ϩ��E2�Ľṹ��ʽ�� ���ڵķ�Ӧ��������ȥ��Ӧ��
���ڵķ�Ӧ��������ȥ��Ӧ�� +2NaOH$��_{��}^{H_{2}O}$
+2NaOH$��_{��}^{H_{2}O}$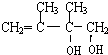 +2NaBr��
+2NaBr��