题目内容
19.铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质.(1)在一定温度下,氧化亚铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H>0
①该反应的平衡常数表达式为:K=$\frac{c{\;}^{3}(CO{\;}_{2})}{c{\;}^{3}(CO)}$
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g.则10min内CO的平均反应速率为0.015mol/(L•min)
(2)Fe3+盐和Al3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性.但Fe3+只有在碱性介质中才能被氧化为FeO42-,请完成下列方程式:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O;
(3)若将ag Fe和Al的混合物溶于2mol/L的足量的硫酸中,再往溶液中加入足量的6mol/L的NaOH溶液,充分反应,过滤,洗涤,干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为30%.
分析 (1)①平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积;
②先根据化学方程式计算出消耗的CO的物质的量,然后根据V=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$求出CO的化学反应速率;
(2)Fe元素化合价由Fe(OH)3中+3价升高为FeO42-中+6价,化合价总升高3价,Cl元素化合价由ClO-中+1价降低为Cl-中-1价,共降低2价,化合价最小公倍数为6,故Fe(OH)3、FeO42-的系数为2,ClO-、Cl-的系数为3,根据题目信息及电荷守恒可知,反应物中缺项为OH-,由元素守恒可知生成物中缺项为H2O,结合原子守恒配平;
(3)Al、Fe混合物与足量硫酸反应后,向溶液中加入足量的NaOH溶液,得到的沉淀为氢氧化铁,将沉淀洗涤,灼烧得到的固体为氧化铁,氧化铁质量与Al、Fe总质量相等,则氧化铁中氧元素质量等于混合物中Al的质量,根据氧化铁化学式计算混合物中Al的质量分数.
解答 解:(1)①因平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,则K=$\frac{c{\;}^{3}(CO{\;}_{2})}{c{\;}^{3}(CO)}$,故答案为:$\frac{c{\;}^{3}(CO{\;}_{2})}{c{\;}^{3}(CO)}$;
②生成了单质铁的物质的量为:$\frac{11.2g}{56g/mol}$=0.2mol,则
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
0.3mol 0.2mol
所以CO的反应速率V=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.3mol}{2L}}{10min}$=0.015mol/(L•min),故答案为:0.015mol/(L•min);
(2)Fe元素化合价由Fe(OH)3中+3价升高为FeO42-中+6价,化合价总升高3价,Cl元素化合价由ClO-中+1价降低为Cl-中-1价,共降低2价,化合价最小公倍数为6,故Fe(OH)3、FeO42-的系数为2,ClO-、Cl-的系数为3,根据题目信息及电荷守恒可知,反应物中缺项为OH-,由元素守恒可知生成物中缺项为H2O,故配平后方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2、3、4OH-、2、3、5H2O;
(3)Al、Fe混合物与足量硫酸反应后,向溶液中加入足量的NaOH溶液,得到的沉淀为氢氧化铁,将沉淀洗涤,灼烧得到的固体为氧化铁,氧化铁质量与Al、Fe总质量相等,则氧化铁中氧元素质量等于混合物中Al的质量,故混合物中Al的质量分数=$\frac{16×3}{56×2+16×3}$×100%=30%,
故答案为:30%.
点评 本题主要考查了化学平衡常数、反应速率的计算、氧化还原反应配平、混合物计算等,侧重考查学生对基础知识的迁移应用、分析解决问题的能力,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 原电池的正极和电解池的阳极都是发生氧化反应 | |
| B. | 用铂做电极电解NaOH溶液时,溶质的质量不变,但浓度却随着电解的进行而增大 | |
| C. | 电解食盐水时,由于OH-离子向阳极移动,所以加酚酞时阳极附近可变红色 | |
| D. | 电解食盐水时,阴极区溶液里H+离子的浓度相对增大,使酚酞试液不变色 |
| A. | NH4Br的电子式  | |
| B. | S2-的结构示意图  | |
| C. | 乙烯的分子式 CH2=CH2 | |
| D. | 原子核内有l7个中子的氯原子${\;}_{17}^{35}$Cl |
| A. | 具有相同的相对原子质量 | B. | 具有相同的中子数 | ||
| C. | 具有相同的核外电子数 | D. | 具有相同的质子数 |
| 除杂试剂 | 方法 | |
| C6H6 (C6H5OH) | ||
| C2H6 (C2H4) | ||
| C6H5Br (Br2) | . |
(3)目前出现的“不粘锅”、不粘油的吸油烟机等等新型厨具,其秘密就是表面有一种叫做“特 富隆”的涂层,实际上就是号称“塑料王”的聚四氟乙烯.试写出用四氟乙烯合成“特富隆”的化学方程式及其反应类型.反应方程式:nCF2=CF2→
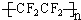 ,类型加聚反应.
,类型加聚反应. 
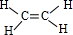
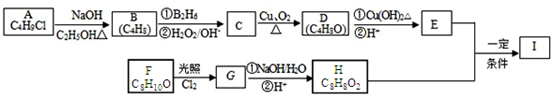
 .
.

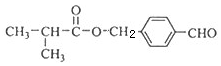 .
. .
.