题目内容
3.CNO-在酸性条件下与NaClO反应生成N2、CO2、Cl2等. 写出CNO-在酸性条件下被NaClO氧化的离子方程式:2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O.分析 根据题意可知,CNO-在酸性条件下与NaClO反应生成N2、CO2、Cl2等,该反应中CNO-的-3价N原子被氧化成+4价的N2,化合价至少升高3×2=6价,NaClO中+1价的Cl元素被还原成-1价的Cl-,化合价降低2价,根据氧化还原反应中化合价升降相等配平.
解答 解:CNO-在酸性条件下与NaClO反应生成N2、CO2、Cl2等,该反应中CNO-的-3价N原子被氧化成+4价的N2,化合价至少升高3×2=6价,NaClO中+1价的Cl元素被还原成-1价的Cl-,化合价降低2价,则CNO-的系数为2,ClO-的系数=$\frac{6}{2}$=3,然后根据观察法配平该反应离子方程式为:2CNO-+3ClO-+2H+=N2↑+2CO2↑++H2O,
故答案为:2 CNO-+3ClO-+2H+=N2↑+2CO2↑+3Cl-+H2O.
点评 本题考查离子方程式书写、氧化还原反应的配平,题目难度中等,明确发生反应的实质为解答关键,注意掌握化合价升降法在氧化还原反应配平中的应用,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
1.向100mL 6mol•L-1 KMnO4溶液中滴加适量稀硫酸,向溶液中缓缓通入5.6L(标准状况)C2H4,恰好完全反应(C2H4中-2价的碱全部转化成CO2),则还原产物中锰元素的化合价为( )
| A. | +6 | B. | +4 | C. | +3 | D. | +2 |
11.用废铜(含少量铁)和工业硫酸制备胆矾的过程如下:
废铜→氧化铜→粗硫酸铜溶液→精硫酸铜溶液→胆矾晶体所需的试剂有:浓度大于150g/L工业H2SO4、3% H2O2溶液、CuCO3粉末、精密pH试纸.
已知:
回答下列问题:
(1)实验室灼烧废铜所需仪器除带铁圈的铁架台、酒精灯外,还有坩埚、泥三角、坩埚钳.
(2)检验氧化铜中是否混有单质铜的实验方法是加入稀硫酸,如有不溶于稀硫酸的红色固体,则证明氧化铜中有单质铜,反之则无.
(3)配置100mL浓度大于150g/L工业H2SO4,需用98%的硫酸(密度为1.84g/cm3)不少于100mL.所需要的主要定量仪器有100mL容量瓶、10mL量筒.
(4)设计由粗硫酸铜溶液制得纯净胆矾晶体的实验方案(含所需试剂与主要步骤) .
.
(5)利用反应:2Cu2++4I-→2CuI↓+I2; I2+2S2O32-→2I-+S4O62-
用标准Na2S2O3溶液滴定可以测定胆矾晶体中铜的含量.需要测定的物理量有胆矾晶体质量(m1)、标准c(Na2S2O3)溶液体积(V1).
测定需在pH=3~4溶液中进行.pH太大带来的影响是Cu2+沉淀;pH太小对实验的影响是Fe3+未除尽.
废铜→氧化铜→粗硫酸铜溶液→精硫酸铜溶液→胆矾晶体所需的试剂有:浓度大于150g/L工业H2SO4、3% H2O2溶液、CuCO3粉末、精密pH试纸.
已知:
| 离子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
(1)实验室灼烧废铜所需仪器除带铁圈的铁架台、酒精灯外,还有坩埚、泥三角、坩埚钳.
(2)检验氧化铜中是否混有单质铜的实验方法是加入稀硫酸,如有不溶于稀硫酸的红色固体,则证明氧化铜中有单质铜,反之则无.
(3)配置100mL浓度大于150g/L工业H2SO4,需用98%的硫酸(密度为1.84g/cm3)不少于100mL.所需要的主要定量仪器有100mL容量瓶、10mL量筒.
(4)设计由粗硫酸铜溶液制得纯净胆矾晶体的实验方案(含所需试剂与主要步骤)
 .
.(5)利用反应:2Cu2++4I-→2CuI↓+I2; I2+2S2O32-→2I-+S4O62-
用标准Na2S2O3溶液滴定可以测定胆矾晶体中铜的含量.需要测定的物理量有胆矾晶体质量(m1)、标准c(Na2S2O3)溶液体积(V1).
测定需在pH=3~4溶液中进行.pH太大带来的影响是Cu2+沉淀;pH太小对实验的影响是Fe3+未除尽.
18.下列有关说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 伴随着能量变化的物质变化都是化学变化 | |
| C. | 如图可表示Ba(OH)2•8H2O与NH4Cl晶体反应的能量变化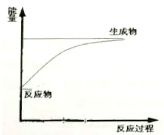 | |
| D. | 1L1mol/L的硫酸与足量的NaOH溶液所放出的热为中和热 |
8.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| B. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| C. | $\frac{1}{18}$mol的H37Cl分子所含中子数为NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
15.下列属于电解质的是( )
| A. | CO2 | B. | NH4NO3 | C. | Cl2 | D. | C6H12O6 |
12.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性.“钴酞菁”分子的结构和性质与人体内的血红素及植物体内的叶绿素非常相似.下列说法中不正确的是( )
| A. | “钴酞菁”分子所形成的分散系不具有丁达尔效应 | |
| B. | “钴酞菁”分子不能透过滤纸 | |
| C. | 此项工作可以用来改变分子的某些物理性质 | |
| D. | 此项工作可广泛应用于光电器件、生物技术等方面 |
13.下列说法不正确的是( )
| A. | 在氧化还原反应中,氧化剂经化学变化变成还原产物 | |
| B. | 在氧化还原反应中,氧化剂被氧化,还原剂被还原 | |
| C. | 在化学反应中,能把其他物质氧化的物质是氧化剂 | |
| D. | 氧化还原反应的本质是电子得失或电子对的偏移 |