题目内容
8.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| B. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| C. | $\frac{1}{18}$mol的H37Cl分子所含中子数为NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
分析 A、求出KHSO4的物质的量,然后根据液态KHSO4能电离出钾离子和硫酸氢根离子来分析;
B、重水的摩尔质量为20g/mol;
C、H37Cl中20个中子;
D、过氧化钠和水反应时,氧元素由-1价变为0价来分析.
解答 解:A、6.8gKHSO4的物质的量为0.05mol,而液态KHSO4能电离出钾离子和硫酸氢根离子,故0.05mol硫酸氢钾中含0.05NA个阳离子,故A错误;
B、重水的摩尔质量为20g/mol,故18g重水的物质的量为0.9mol,故含9NA个质子,故B错误;
C、H37Cl中20个中子,故$\frac{1}{18}$mol的H37Cl中含$\frac{10}{9}$NA个中子,故C错误;
D、过氧化钠和水反应时,氧元素由-1价变为0价,故当生成0.1mol氧气时转移0.2NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
16.下列说法正确的是( )
| A. | 化学反应伴随能量变化,是化学反应的基本特征之一 | |
| B. | 常温下,氢氧化钡晶体与氯化铵晶体混合放出氨气,该反应为放热反应 | |
| C. | 化学反应中能量变化的大小与反应物的质量多少无关 | |
| D. | 旧化学键断裂所放出的能量高于新化学键形成所吸收的能量时发生放热反应 |
20.2016年6月25日,我国新一代运载火箭长征七号在海南文昌反射成功.“长征七号”运载火箭使用的是液氧煤油推进剂,下列说法不正确的是( )
| A. | 工业上通过将空气冷凝成液体后再分离的方式获得液氧 | |
| B. | 推进剂燃烧后的主要产物是水和二氧化碳 | |
| C. | 煤油属于纯净物,主要成分是烃 | |
| D. | 氧气与煤油的反应是放热反应 |

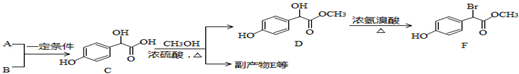
 ;
;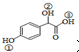 )中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②;
)中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②; .
.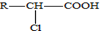 .A有多种合成方法,请写出由乙酸合成A的路线流程图(其他原料任选),合成路线流程图示例如下:H2C=CH2$→_{催化剂,△}^{H_{2}}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOC2H5.
.A有多种合成方法,请写出由乙酸合成A的路线流程图(其他原料任选),合成路线流程图示例如下:H2C=CH2$→_{催化剂,△}^{H_{2}}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOC2H5.