题目内容
18.已知反应如下:N2(g)+3H2(g)?2NH3(g),在某条件下一定量的N2 和一定量的H2反应生成4mol NH3时放出的热量为184.0kJ,将相同条件下的1mol N2 和3mol H2 放在一密闭容器中进行充分反应,测得反应放出的热量为( )| A. | 一定大于92.0 kJ | B. | 一定等于92.0 kJ | C. | 一定小于92.0 kJ | D. | 不能确定 |
分析 可逆反应中,反应物不可能完全转化成生成物,则1mol N2 和3mol H2 放在一密闭容器中进行充分反应,生成氨气的物质的量一定小于2mol,则放出的热量一定小于92.0kJ.
解答 解:在某条件下一定量的N2 和一定量的H2反应生成4mol NH3时放出的热量为184.0kJ,则生成2mol氨气放出的热量为:184.0kJ×$\frac{2mol}{4mol}$=92.0kJ,
由于该反应为可逆反应,则1mol N2 和3mol H2 充分反应后生成氨气的物质的量一定小于2mol,放出的热量一定小于92.0kJ,
故选C.
点评 本题考查了反应热计算、可逆反应特点,题目难度不大,明确可逆反应特点为解答关键,注意掌握化学反应与能量变化的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
8.下列物质中,不跟SiO2反应的是( )
| A. | 烧碱溶液 | B. | 熔融的纯碱 | C. | 氢氟酸 | D. | 盐酸 |
9.已知烷烃C4H10的同分异构体有2种,则C3NH9的同分异构体有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
6.CH3COOH分别跟H-18O-C2H5和H-16O-C2H5酯化反应后,两者生成的水分子的相对分子质量( )
| A. | 相等 | B. | 前者小 | C. | 前者大 | D. | 不能确定 |
3.目前用量最大、用途最广泛的合金是( )
| A. | 青铜 | B. | 黄铜 | C. | 生铁 | D. | 钢 |
7.下列有机物既能发生加成反应,又能发生消去反应的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
8.盛放液溴的试剂瓶中要加一定量的水,其目的是( )
| A. | 把溴溶于水得到溴水 | B. | 将液溴与空气隔绝防止溴被氧化 | ||
| C. | 减少液溴挥发 | D. | 防止溴升华 |
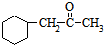 )的流程如图:
)的流程如图: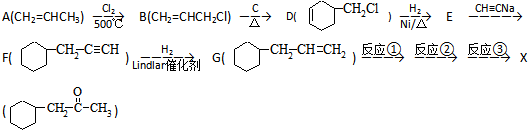 )
)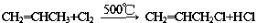 ;写出反应③的化学方程式
;写出反应③的化学方程式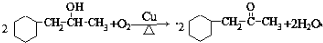 ;
;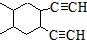 合成线路(其他试剂任选).
合成线路(其他试剂任选).