题目内容
在下列事实中,什么因素影响了化学反应的速率?
(1)同浓度、同体积的盐酸中放入同样大小的锌粒和镁粒,产生气体有快有慢 ;
(2)黄铁矿煅烧时要粉碎成细小的矿粒 ;
(3)熔融的KClO3放出气泡很慢,撒入少量MnO2很快产生气体 ;
(4)同样大小的石灰石分别在0.1mol?L-1的盐酸和1mol?L-1的盐酸中反应速率不同 ;
(5)夏天的食品易霉变,冬天就不易发生该现象 .
(1)同浓度、同体积的盐酸中放入同样大小的锌粒和镁粒,产生气体有快有慢
(2)黄铁矿煅烧时要粉碎成细小的矿粒
(3)熔融的KClO3放出气泡很慢,撒入少量MnO2很快产生气体
(4)同样大小的石灰石分别在0.1mol?L-1的盐酸和1mol?L-1的盐酸中反应速率不同
(5)夏天的食品易霉变,冬天就不易发生该现象
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:影响化学反应速率的因素有内因和外因,内因为物质的性质,为主要因素,常见影响化学反应速率的外因有浓度、温度、压强、催化剂以及固体的表面积等,一般来说浓度越大、温度越高、压强越大以及增大固体表面积、加入催化剂等,都可增大反应速率,以此解答.
解答:
解:(1)锌与镁的活动性顺序不同,与盐酸反应的剧烈程度不同,故答案为:物质的性质;
(2)黄铁矿煅烧时要粉碎成细小的矿粒,固体表面积增加,则反应速率增大,故答案为:固体表面积;
(3)MnO2为该反应的催化剂,可加快反应速率,故答案为:催化剂;
(4)盐酸的浓度不同,为影响反应速率的主要因素,浓度越大,反应速率越大,故答案为:溶液的浓度;
(5)冬天温度较低,反应速率较慢,故答案为:温度.
(2)黄铁矿煅烧时要粉碎成细小的矿粒,固体表面积增加,则反应速率增大,故答案为:固体表面积;
(3)MnO2为该反应的催化剂,可加快反应速率,故答案为:催化剂;
(4)盐酸的浓度不同,为影响反应速率的主要因素,浓度越大,反应速率越大,故答案为:溶液的浓度;
(5)冬天温度较低,反应速率较慢,故答案为:温度.
点评:本题考查化学反应素的影响因素,为高频考点,侧重于学生的分析能力和基本概念、理论知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
X、Y、Z、W为短周期元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z最外层电子数之和为10,下列说法正确的是( )
| A、Y的最高价氧化物对应的水化物一定是碱 |
| B、稳定性:W的氢化物>Z的氢化物,沸点:W的氢化物<Z的氢化物 |
| C、若X、Y、W形成的化合物为XYW2,则其水溶液显酸性 |
| D、X、Y的氧化物晶体类型不一定相同 |
常温下,有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
| A、四种溶液的pH的大小顺序:①>④>③>② |
| B、将溶液①、②等体积混合所得碱性溶液中:c(NH4+)<c(NH3?H2O) |
| C、向溶液①、②中分别滴加25mL 0.1mol/L盐酸后,溶液中c(NH4+):①>② |
| D、将溶液③、④等体积混合所得溶液中:2 c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) |
 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.
 )是一种医药中间体,用茴香醛(
)是一种医药中间体,用茴香醛(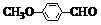 )经两步反应合成D,请写出第②步反应的化学方程式(其他原料自选,并注明必要的反应条件).
)经两步反应合成D,请写出第②步反应的化学方程式(其他原料自选,并注明必要的反应条件).
 转化为
转化为 ,其合成线路如下:
,其合成线路如下: 写(Ⅱ)(Ⅲ)两步反应的化学方程式:
写(Ⅱ)(Ⅲ)两步反应的化学方程式:
 对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
