题目内容
13.甲、乙、丙、丁分别由H+、Na+、Al3+、Ba2+..OH-、Cl-、HCO3-离子中的两种组成的化合物,可以发生如图转化:下列说法错误的是( )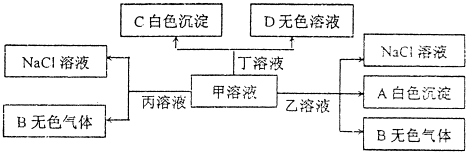
| A. | 乙为AlC13 | |
| B. | 能大量共存于溶液丙中的离子:Fe3+、SO42-、NO3- | |
| C. | 甲溶液中粒子的等量关系:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 甲溶液中滴加少量丁溶液反应的离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O |
分析 甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成,由离子共存,H+只能与Cl-组成HCl,Al3+只能与Cl-组成AlCl3,甲溶液能和乙溶液生成白色沉淀A、气体和氯化钠,应是铝离子与碳酸氢根发生的双水解反应,A为Al(OH)3,B为CO2,甲、乙分别为AlCl3、NaHCO3中的一种,甲与丙反应得到氯化钠与二氧化碳,则甲为NaHCO3,乙为AlCl3,丙为HCl,甲与丁反应得到白色沉淀C与无色反应D,则丁为Ba(OH)2,由于物质的用量不确定,则D为NaOH或碳酸钠.
解答 解:甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成,由离子共存,H+只能与Cl-组成HCl,Al3+只能与Cl-组成AlCl3,甲溶液能和乙溶液生成白色沉淀A、气体和氯化钠,应是铝离子与碳酸氢根发生的双水解反应,A为Al(OH)3,B为CO2,甲、乙分别为AlCl3、NaHCO3中的一种,甲与丙反应得到氯化钠与二氧化碳,则甲为NaHCO3,乙为AlCl3,丙为HCl,甲与丁反应得到白色沉淀C与无色反应D,则丁为Ba(OH)2,由于物质的用量不确定,则D为NaOH或碳酸钠.
A.由上述分析可知,乙为AlCl3,故A正确;
B.丙为HCl,含有H+,该组离子之间不反应,可大量共存,故B正确;
C.甲为NaHCO3,根据物料守恒:c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3),故C正确;
D.甲为NaHCO3,丁为Ba(OH)2,甲溶液中滴加少量丁溶液反应的离子方程式:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32-,故D错误;
故选D.
点评 本题考查无机物的推断,为高频考点,把握离子之间的反应、白色沉淀和气体的判断等为解答的关键,侧重分析与推断能力的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加NaI溶液可以得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 加热NH4Cl | B. | 干冰汽化 | C. | HCl溶于水 | D. | NaOH固体熔化 |
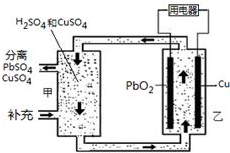 流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图.下列说法错误的是( )
流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图.下列说法错误的是( )| A. | Cu为负极 | |
| B. | PbO2电极的电极反应式为:PbO2+4H++SO42-+2e-=PbSO4+2H2O | |
| C. | 甲中应补充硫酸 | |
| D. | 当消耗1 mol PbO2,需分离出2 mol CuSO4 |
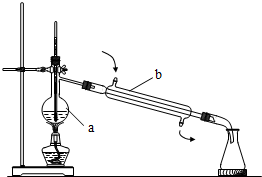 (1)写出如图所指仪器的名称:
(1)写出如图所指仪器的名称:

 .
. ;
; .
. (只写出一种即可)
(只写出一种即可)