题目内容
8.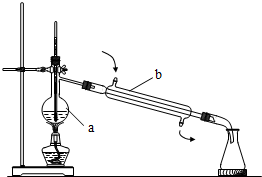 (1)写出如图所指仪器的名称:
(1)写出如图所指仪器的名称:a.蒸馏烧瓶,
b.冷凝管.
(2)判断如图蒸馏装置是否正确错误(填“正确”或“错误”).
(3)在萃取、分液实验中所用的带活塞的玻璃仪器名称是分液漏斗,静置后分液的第一步操作是打开(填“打开”或“关闭”)分液漏斗顶部的塞子.
(4)在进行分液操作时,下层液体从分液漏斗下口放出,上层液体从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
分析 (1)根据仪器的形状、结构、用途回答;
(2)在加热烧瓶时应该垫石棉网并放在铁圈上;利用沸点不同,通过加热,控制蒸汽温度,分馏各组分,温度计水银球在蒸馏烧瓶支管口处;冷凝管应该通过铁架台和铁夹固定,同时下口进水上口出水才能使冷凝管内充满冷水,达到最佳冷凝效果;
(3)萃取分液的主要仪器是分液漏斗,要想实现分液操作,静置后应先打开分液漏斗上端活塞使瓶内外气压相等,然后下层液体从下端流出,上层液体从上口倒出;
(4)分液漏斗中下层液体从下口放出,上层液体从上口倒出.
解答 解:(1)根据仪器的形状、结构、用途可知,a为蒸馏烧瓶,b为冷凝管;
故答案为:蒸馏烧瓶;冷凝管;
(2)实验中,在加热烧瓶时应该垫石棉网并放在铁圈上,防止蒸馏水瓶炸裂;温度计水银球在蒸馏烧瓶支管口处;冷凝管应该通过铁架台和铁夹固定,同时下口进水上口出水才能使冷凝管内充满冷水,达到最佳冷凝效果;
故答案为:错误;
(3)萃取分液的主要仪器是分液漏斗,要想实现分液操作,静置后应先打开分液漏斗上端活塞使瓶内外气压相等,然后下层液体从下端流出,上层液体从上口倒出;
故答案为:分液漏斗;打开;
(4)分液时,保证被分离液体的纯净,分液漏斗下层液体从下口放出,上层液体从上口倒出;
故答案为:上口倒出.
点评 本题为实验题,考查了蒸馏实验、萃取、分液用到的仪器及操作和注意事项,明确实验原理是解题关键,注意蒸馏实验中温度计位置、冷凝水流向为易错点,题目难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
18.下列各组物质或物质间反应可能包括多步反应,其总的离子方程式正确的是( )
| A. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | Na2S投入水中:S2-+2H2O?H2S+2OH- | |
| C. | 向含1molAlCl3溶液中投入4molNa:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═Al(OH)3↓+3BaSO4↓ |
19.有机物X、Y的分子式不同,它们都只含C、H、O元素中的两种或三种,等物质的量的X和Y完全燃烧时消耗氧气和生成的二氧化碳的物质的量均相同,X、Y可能是( )
| A. | C2H4、C2H6O | B. | C2H2、C6H6 | C. | CH2O、C3H6O2 | D. | CH4、C2H4O2 |
16.下列反应的离子方程式书写正确的是( )
| A. | 稀醋酸与氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 铜粉与稀硝酸反应:Cu+2H+═Cu2++H2↑ | |
| C. | 氯气与碘化钾溶液反应:Cl2+2I-═I2+2Cl- | |
| D. | 碳酸钙与足量盐酸反应:CO32-+2H+═H2O+CO2↑ |
3.反应A+B═C,在5s内A的浓度由6.0mol/L变为2.0mol/L,则用A表示的反应速率为( )
| A. | 0.8mol/(L•s) | B. | 2.0mol/(L•s) | C. | 4.0mol/(L•s) | D. | 6.0mol/(L•s) |
13.甲、乙、丙、丁分别由H+、Na+、Al3+、Ba2+..OH-、Cl-、HCO3-离子中的两种组成的化合物,可以发生如图转化:下列说法错误的是( )
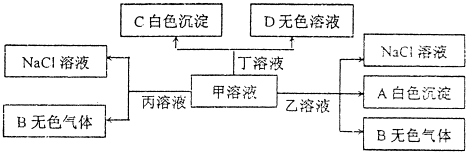

| A. | 乙为AlC13 | |
| B. | 能大量共存于溶液丙中的离子:Fe3+、SO42-、NO3- | |
| C. | 甲溶液中粒子的等量关系:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 甲溶液中滴加少量丁溶液反应的离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O |
20.25℃时,1mol/L醋酸加水稀释至0.01mol/L,关于稀释前后的下列变化正确的是( )
| A. | 溶液中c(OH-)减小 | B. | pH的变化值等于2 | ||
| C. | 溶液中H+的个数增大 | D. | Kw的值减小 |
17.下列有关化学与生活的说法错误的是( )
| A. | 铁粉、生石灰均可作食品抗氧化剂 | |
| B. | 明矾、氯化铁均可作净水剂 | |
| C. | 牛奶、鸡蛋清均可用于重金属中毒解毒 | |
| D. | 碘酒、双氧水均可用于伤口消毒 |
18.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | lmol H2O2分子中的非极性共价键数为NA | |
| B. | 1L 0.lmol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 钢铁发生析氢腐蚀时,0.56gFe反应转移电子数为0.03NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA |