题目内容
11.把SO2通入NaOH溶液中,当SO2和NaOH完全反应时,其质量比为6:5,则下列说法正确的是( )| A. | 反应后SO2有剩余 | |
| B. | 溶液还可吸收SO2 | |
| C. | 溶液中除OH-外,只存在一种阴离子 | |
| D. | 溶液中溶质(正盐与酸式盐)的物质的量之比为2:1 |
分析 把SO2通入NaOH溶液中,当SO2和NaOH完全反应时,其质量比为6:5,物质的量=$\frac{6}{64}$:$\frac{5}{40}$=3:4,当n(SO2):n(NaOH)=1:2反应生成Na2SO3,当n(SO2):n(NaOH)=1:1反应生成NaHSO3,当1:2<n(SO2):n(NaOH)<1:1,反应生成Na2SO3和NaHSO3的混合物,n(SO2):n(NaOH)=3:4介于1:2---1:1范围内生成的是Na2SO3和NaHSO3的混合物.
解答 解:根据题意知,把SO2通入NaOH溶液中,当二氧化硫和氢氧化钠的物质的量之比为1:2,发生反应SO2+2NaOH═Na2SO3+H2O,当二氧化硫和氢氧化钠的物质的量之比为1:1,发生反应SO2+NaOH═NaHSO3;现二者的质量比为6:5,物质的量=$\frac{6}{64}$:$\frac{5}{40}$=3:4,介于1:2和1:1之间,两个反应都发生,二氧化硫和氢氧化钠没有剩余,产物为Na2SO3和NaHSO3的混合物,
A.由上述分析知,反应后SO2没有剩余,故A错误;
B.反应后溶质中含有亚硫酸钠,则溶液还可吸收SO2,故B正确;
C.溶液中除OH-外,还存在亚硫酸根和亚硫酸氢根两种阴离子,故C错误;
D.当SO2和NaOH按照3:4完全反应时,配平化学方程式得到3SO2+4NaOH=Na2SO3+2NaHSO3+H2O,溶液中Na2SO3和NaHSO3的溶质的物质的量之比为1:2,故D错误;
故选B.
点评 本题考查化学方程式有关计算,题目难度中等,根据方程式确定反应后溶质是关键,注意掌握发生反应原理,试题培养了学生的化学计算能力.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
12.下列说法正确的是( )
| A. | 强酸、强碱都是强电解质 | B. | 可溶性碱都是强电解质 | ||
| C. | 难溶于水的化合物都是弱电解质 | D. | 能导电的物质都是电解质 |
3.短周期主族元素X、Y、Z、R原子序数依次增大且最外层电子数之和为18.Y、R同主族,短周期中Z原子半径最大,Y最外层电子数是次外层的3倍.下列推断正确的是( )
| A. | 化合物Z2R2中只含有离子键不含共价键 | |
| B. | 元素Y的简单气态氢化物的热稳定性比R弱 | |
| C. | 离子半径从大到小的顺序为R>Z>X>Y | |
| D. | 一定条件下,Y单质可以将X单质从其氢化物中置换出来 |
20.向Fe和Fe2O3混合粉末中加入足量稀硫酸,充分反应后生成FeSO4溶液.若生成的Fe2+和H2的物质的量之比为4:1时,则被氧化的Fe与被还原Fe3+的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
1.铁在一定条件下可以和许多物质发生反应.下列对有关反应现象的描述,正确的是( )
| A. | 在空气中点燃细铁丝会火星四射 | |
| B. | 在氯气中点燃细铁丝会产生白色的烟 | |
| C. | 铁粉和硫粉混合加热会生成黑色的固体 | |
| D. | 将一枚铁钉浸入CuSO4溶液,反应完全后,铁钉表面变为红色,溶液由蓝色变为黄色 |
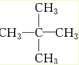 .
.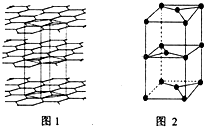 A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子.
A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子. .
.