题目内容
过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.对于下列A~F涉及H2O2的反应,回答相关问题:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4=MnO2+H2SO4
(1)H2O2仅体现还原性的反应是(填代号) .
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) .
(3)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是: .
(4)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→O2
①该反应中,发生还原反应的过程是 → .
②写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目
③如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 .
(5)由于H2O2有较强氧化性,能使某些有色试剂褪色,具有漂白作用,另外它还有弱酸性,某学生将H2O2溶液滴入含有酚酞的氢氧化钠溶液中,观察到溶液的红色消失.为了探究溶液褪色的原因,该学生提出了两种假设,然后又设计了一个简单的实验方案,以验证这两种假设.请回答:
(A)该学生提出的两种假设是:
假设① ;
假设② .
(B)将该学生设计的简单实验方案、预测的实验现象及结论填入下表(结论部分只需填①或②):
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
E.H2O2+MnSO4=MnO2+H2SO4
(1)H2O2仅体现还原性的反应是(填代号)
(2)H2O2既体现氧化性又体现还原性的反应是(填代号)
(3)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是:
(4)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→O2
①该反应中,发生还原反应的过程是
②写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目
③如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
(5)由于H2O2有较强氧化性,能使某些有色试剂褪色,具有漂白作用,另外它还有弱酸性,某学生将H2O2溶液滴入含有酚酞的氢氧化钠溶液中,观察到溶液的红色消失.为了探究溶液褪色的原因,该学生提出了两种假设,然后又设计了一个简单的实验方案,以验证这两种假设.请回答:
(A)该学生提出的两种假设是:
假设①
假设②
(B)将该学生设计的简单实验方案、预测的实验现象及结论填入下表(结论部分只需填①或②):
| 简单实验方案 | 预测的实验现象 | 结论 |
| 假设 | ||
| 假设 |
考点:氧化还原反应,氧化还原反应的电子转移数目计算,过氧化氢
专题:氧化还原反应专题,氧族元素
分析:(1)(2)根据化合价的升降判断:化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂;
(3)根据氧化剂、氧化产物的氧化性规律:氧化剂的氧化性强于氧化产物的氧化性;
(4)该反应中H2O2只发生如下过程:H2O2→O2,O元素化合价升高,H2O2被氧化,根据化合价的变化可知,反应中H2CrO4为氧化剂,被还原为Cr(OH)3,反应的方程式为2+3H2O2=2Cr(OH)3+3O2↑+2H2O,根据化合价的变化判断电子转移的数目,以此解答该题;
(5)(A)能使酚酞褪色的原因有两个:一个是体现双氧水的强氧化性,一个是体现双氧水的酸性;
(B)向褪色后的溶液中加氢氧化钠溶液,根据溶液颜色的变化判断是哪种情况.
(3)根据氧化剂、氧化产物的氧化性规律:氧化剂的氧化性强于氧化产物的氧化性;
(4)该反应中H2O2只发生如下过程:H2O2→O2,O元素化合价升高,H2O2被氧化,根据化合价的变化可知,反应中H2CrO4为氧化剂,被还原为Cr(OH)3,反应的方程式为2+3H2O2=2Cr(OH)3+3O2↑+2H2O,根据化合价的变化判断电子转移的数目,以此解答该题;
(5)(A)能使酚酞褪色的原因有两个:一个是体现双氧水的强氧化性,一个是体现双氧水的酸性;
(B)向褪色后的溶液中加氢氧化钠溶液,根据溶液颜色的变化判断是哪种情况.
解答:
解:A.Na2O2+2HCl═2NaCl+H2O2中各元素化合价不变,所以不属于氧化还原反应;
B.Ag2O+H2O2═2Ag+O2↑+H2O中Ag元素化合价由+1价变为0价、O元素化合价由-1价变为0价,所以氧化银是氧化剂、双氧水是还原剂,Ag2O的氧化性大于H2O2的氧化性;
C.2H2O2═2H2O+O2↑中O元素由-1价变为0价和-2价,所以双氧水是氧化剂和还原剂;
D.3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O中Cr元素化合价由+3价变为+6价、O元素化合价由-1价变为-2价,所以双氧水是氧化剂,硫酸铬是还原剂,H2O2的氧化性大于K2CrO4的氧化性,
E.H2O2+MnSO4=MnO2+H2SO4中Mn元素的价态从+2价升高到+4价,H2O2中O元素化合价由-1价变为-2价,所以双氧水是氧化剂,MnSO4是还原剂.
(1)H2O2仅体现还原性的反应是B,故选B;
(2)H2O2既体现氧化性又体现还原性的反应是C,故选C;
(3)根据反应B和D,知道氧化性的关系是:Ag2O>H2O2>K2CrO4,故答案为:Ag2O>H2O2>K2CrO4;
(4)①H2O2→O2的过程中,氧元素的化合价由-1价升到了0价,所以H2O2是还原剂,反应中Cr元素化合价降低,H2CrO4应被还原生成Cr(OH)3,该过程即为发生还原反应的过程,故答案为:H2CrO4;Cr(OH)3;
②反应的方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,反应中Cr元素化合价由+6价降低为+3价,O元素化合价由-1价升高到0价,则转移电子数目和方向可表示为 ,故答案为:
,故答案为: ;
;
③根据②,当生成3mol氧气转移电子是6mol,所以当转移电子0.3mol时,生成氧气的物质的量是0.15mol,体积是0.15mol×22.4L/mol=3.36L,故答案为:3.36L;
(5)(A)通过题意知,双氧水有强氧化性和酸性,所以提出的两种假设为:过氧化氢和氢氧化钠发生中和反应;过氧化氢将酚酞氧化,
故答案为:过氧化氢和氢氧化钠发生中和反应;过氧化氢将酚酞氧化;
(B)向褪色后的溶液中加氢氧化钠溶液,根据溶液颜色的变化判断是哪种情况,如果溶液又变红色,则假设①成立;如果溶液颜色无变化,则假设②成立,
故答案为:
.
B.Ag2O+H2O2═2Ag+O2↑+H2O中Ag元素化合价由+1价变为0价、O元素化合价由-1价变为0价,所以氧化银是氧化剂、双氧水是还原剂,Ag2O的氧化性大于H2O2的氧化性;
C.2H2O2═2H2O+O2↑中O元素由-1价变为0价和-2价,所以双氧水是氧化剂和还原剂;
D.3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O中Cr元素化合价由+3价变为+6价、O元素化合价由-1价变为-2价,所以双氧水是氧化剂,硫酸铬是还原剂,H2O2的氧化性大于K2CrO4的氧化性,
E.H2O2+MnSO4=MnO2+H2SO4中Mn元素的价态从+2价升高到+4价,H2O2中O元素化合价由-1价变为-2价,所以双氧水是氧化剂,MnSO4是还原剂.
(1)H2O2仅体现还原性的反应是B,故选B;
(2)H2O2既体现氧化性又体现还原性的反应是C,故选C;
(3)根据反应B和D,知道氧化性的关系是:Ag2O>H2O2>K2CrO4,故答案为:Ag2O>H2O2>K2CrO4;
(4)①H2O2→O2的过程中,氧元素的化合价由-1价升到了0价,所以H2O2是还原剂,反应中Cr元素化合价降低,H2CrO4应被还原生成Cr(OH)3,该过程即为发生还原反应的过程,故答案为:H2CrO4;Cr(OH)3;
②反应的方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,反应中Cr元素化合价由+6价降低为+3价,O元素化合价由-1价升高到0价,则转移电子数目和方向可表示为
 ,故答案为:
,故答案为: ;
;③根据②,当生成3mol氧气转移电子是6mol,所以当转移电子0.3mol时,生成氧气的物质的量是0.15mol,体积是0.15mol×22.4L/mol=3.36L,故答案为:3.36L;
(5)(A)通过题意知,双氧水有强氧化性和酸性,所以提出的两种假设为:过氧化氢和氢氧化钠发生中和反应;过氧化氢将酚酞氧化,
故答案为:过氧化氢和氢氧化钠发生中和反应;过氧化氢将酚酞氧化;
(B)向褪色后的溶液中加氢氧化钠溶液,根据溶液颜色的变化判断是哪种情况,如果溶液又变红色,则假设①成立;如果溶液颜色无变化,则假设②成立,
故答案为:
| 简单实验方案 | 预测的实验现象 | 结论 |
| 向褪色后的溶液中再加入过量NaOH溶液 | 溶液又变红色 | ① |
| 溶液颜色无变化(依然为无色) | ② |
点评:本题考查了双氧水的性质,根据元素化合价变化来确定双氧水的性质,中学阶段只有双氧水和过氧化钠中氧元素显-1价,熟练掌握特殊现象,题目难度不大.

练习册系列答案
相关题目
元素周期表中位置相近的元素性质相似,人们可以借助元素周期表研究合成有特定性质的新物质.为合成具有半导体性质的材料,适宜在周期表中哪个区域寻找( )
| A、金属与非金属交界处 |
| B、过渡元素区域(副族和第Ⅷ族) |
| C、长周期金属元素区域 |
| D、长周期非金属元素区域 |
下列有机物中,常温常压下呈气态的是( )
| A、己烯 | B、硝基苯 |
| C、甘油 | D、一氯甲烷 |
我国政府已启动“酱油补铁工程”.这里的铁指的是( )
| A、铁元素 | B、铁单质 |
| C、四氧化三铁 | D、硫酸铁 |
根据原子结构及元素周期律的知识,下列推断正确的是( )
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| B、核外电子排布相同的微粒化学性质也相同 | ||||
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 | ||||
D、
|
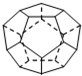 (1)德国和美国科学家首先制出由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成 (如图所示).请回答:C20分子共有
(1)德国和美国科学家首先制出由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成 (如图所示).请回答:C20分子共有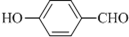 的沸点比
的沸点比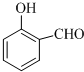 高,其原因是
高,其原因是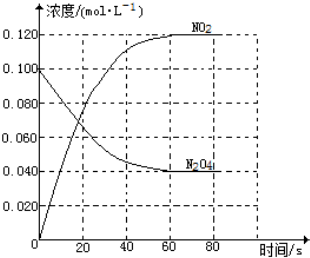 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.