题目内容
有一处于平衡状态的反应:A(g)+3B(s)?2E(g),正反应放热.为使平衡状态向生成E的方向移动,适宜的条件是( )
①高温、②低温、③高压、④低压、⑤加催化剂、⑥将E分离除去.
①高温、②低温、③高压、④低压、⑤加催化剂、⑥将E分离除去.
| A、①③⑥ | B、②③⑥ |
| C、②④⑥ | D、②④⑤⑥ |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A(g)+3B(s)?2E(g),正反应放热,体积增大,B为固体,使平衡状态向生成E的方向移动,平衡正向进行,结合平衡影响因素和平衡移动原理分析判断;
解答:
解:A(g)+3B(s)?2E(g),正反应放热,体积增大,B为固体,使平衡状态向生成E的方向移动,平衡正向进行,
①反应是放热反应,高温平衡逆向进行,故①错误;
②反应是放热反应,低温正向进行,故②正确;
③反应是气体体积增大的反应,高压平衡逆向进行,故③错误;
④反应是气体体积增大的反应,低压平衡性气体体积增大的方向进行,故④正确;
⑤加催化剂改变反应速率不改变化学平衡,平衡不动,故⑤错误;
⑥将E分离除去,平衡正向进行,故⑥正确;
故选C.
①反应是放热反应,高温平衡逆向进行,故①错误;
②反应是放热反应,低温正向进行,故②正确;
③反应是气体体积增大的反应,高压平衡逆向进行,故③错误;
④反应是气体体积增大的反应,低压平衡性气体体积增大的方向进行,故④正确;
⑤加催化剂改变反应速率不改变化学平衡,平衡不动,故⑤错误;
⑥将E分离除去,平衡正向进行,故⑥正确;
故选C.
点评:本题考查了化学平衡影响因素的分析判断,化学平衡移动原理实质理解、反应特征分析是解题关键,题目较简单.

练习册系列答案
相关题目
一块金属钠投入过量的AlCl3溶液中,生成物是( )
| A、Al、NaCl |
| B、H2、Al(OH)3 |
| C、H2、NaCl、NaAlO2 |
| D、H2、NaCl、Al(OH)3 |
下列无色溶液中都能大量共存的离子组是( )
| A、K+、CO32-、Ag+、SO42- |
| B、Na+、Cu2+、SO42-、Cl- |
| C、NO3-、Na+、MnO4-、K+ |
| D、Ca2+、K+、Cl-、NO3- |
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;
Na2O2(s)+CO2(g)=Na2CO3(s)+
O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2(g)=Na2CO3(s)+
| 1 |
| 2 |
根据以上热化学方程式判断,下列说法正确的是( )
| A、CO的燃烧热为283 kJ |
B、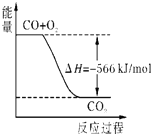 如图可表示由CO生成CO2的反应过程和能量关系 |
| C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol |
| D、CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为1.204×1024个 |
在相同温度下,等体积等物质的量浓度的4种稀溶液:①Na2SO4、②H2S、③NaHSO3、④Na2S中所含带电微粒数由多到少的顺序是( )
| A、①=④>③=② |
| B、④=①>③>② |
| C、①>④>③>② |
| D、④>①>③>② |
下列离子方程式书写正确的是( )
| A、明矾溶液中加入过量的氨水A13++4NH3?H20=AlO2-+4NH4++2H2O | ||
| B、在FeI2溶液中滴入少量溴水2Fe2++4I-+3Br2=2Fe3++2I2+6Br- | ||
C、碳酸钠溶液中逐滴加入与之等物质的量的盐酸:CO
| ||
| D、乙酸溶液中加入少量碳酸氢铵溶液CH3COOH+HCO3-=CH3COO-+CO2↑+H2O |
向2.5mL 0.2mol/L的Na2CO3溶液中慢慢加入0.1mol/L的盐酸7.5mL,在标况下产生CO2气体的体积是( )
| A、8.4 mL |
| B、5.6 mL |
| C、4.2 mL |
| D、2.8 mL |