题目内容
在100mL 0.1mol/L的MgCl2溶液中Cl-的物质的量浓度为( )
| A、0.01mol/L |
| B、0.02mol/L |
| C、0.1 mol/L |
| D、0.2 mol/L |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:根据同一化学式中各微粒的浓度=物质的物质的量浓度×离子个数,与溶液的体积无关.
解答:
解:在100mL 0.1mol/L的MgCl2溶液中Cl-的物质的量浓度=0.1mol/L×2=0.2mol/L;
故选D.
故选D.
点评:本题考查物质的量浓度的计算与理解,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.

练习册系列答案
相关题目
下列说法正确的是( )
| A、含有氧元素的化合物一定是氧化物 |
| B、在水溶液中能电离出H+的化合物一定是酸 |
| C、盐一定是有金属阳离子和酸根离子构成 |
| D、HCl不导电 |
一块金属钠投入过量的AlCl3溶液中,生成物是( )
| A、Al、NaCl |
| B、H2、Al(OH)3 |
| C、H2、NaCl、NaAlO2 |
| D、H2、NaCl、Al(OH)3 |
下列是有关实验操作的步骤和做法,不正确的是( )
| A、粗盐提纯中除泥沙的操作顺序是:溶解、过滤、蒸发 |
| B、萃取操作时,所选萃取剂的密度没有特别限制 |
| C、蒸馏操作时,冷凝管从上面进水,从下面出水 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
已知:2CO(g)+O2═2CO2(g)△H═-566kj?mol-1
Na2O2(s)+CO2═Na2Co3(s)+
△H═-266kJ?mol-1
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2═Na2Co3(s)+
| 1 |
| 2 |
根据以上热化学方程式判断,下列说法正确的是( )
| A、CO的燃烧热为283kJ |
B、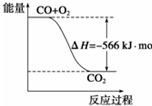 可表示有CO生成CO2的反应过程和能量关系 |
| C、Na2O2(s)+2CO2═Na2Co3(s)+O2(g)△H>-532kJ?mol-1 |
| D、CO(g)与Na2O2(s)反应放出549kJ热量时,电子转移数为6.02×1023 |
对下列实验的现象描述正确的是( )

| A、实验①溶液褪色 |
| B、实验③溶液中看到一条光亮的通路 |
| C、实验②溶液褪色 |
| D、实验④饱和碳酸钠溶液下方出现油状液体 |
下列无色溶液中都能大量共存的离子组是( )
| A、K+、CO32-、Ag+、SO42- |
| B、Na+、Cu2+、SO42-、Cl- |
| C、NO3-、Na+、MnO4-、K+ |
| D、Ca2+、K+、Cl-、NO3- |
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;
Na2O2(s)+CO2(g)=Na2CO3(s)+
O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2(g)=Na2CO3(s)+
| 1 |
| 2 |
根据以上热化学方程式判断,下列说法正确的是( )
| A、CO的燃烧热为283 kJ |
B、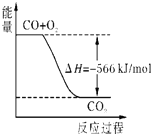 如图可表示由CO生成CO2的反应过程和能量关系 |
| C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol |
| D、CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为1.204×1024个 |