题目内容
18.NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1 mol-OH(羟基)与l mol NH4+中所含电子数均为10NA | |
| B. | 25℃时,100 mL pH=l的稀硫酸中,含有的H+数目为0.01 NA | |
| C. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1 NA | |
| D. | 标准状况下,2.24LNO2和N2O4混合气体中含0.2 NA个氧原子 |
分析 A、羟基不显电性;
B、pH=1的硫酸中氢离子浓度为0.1mol/L;
C、在氢氧化钠溶液中,水的电离被抑制;
D、NO2和N2O4中含有的氧原子个数不同.
解答 解:A、羟基不显电性,故1mol羟基中含9mol电子即9NA个,故A错误;
B、pH=1的硫酸中氢离子浓度为0.1mol/L,故100mL溶液中氢离子的物质的量为n=CV=0.1mol/L×0.1L=0.01mol,个数为0.01NA个,故B正确;
C、在氢氧化钠溶液中,水的电离被抑制,故溶液中氢氧根几乎全部来自于水的电离,即水电离出的氢氧根的个数小于0.1NA个,故C错误;
D、NO2和N2O4中含有的氧原子个数不同,故标况下2.24L混合气体即0.1mol混合气体中氧原子的个数介于0.2NA到0.4NA之间,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.下列实验方案中,可以达到实验目的是
( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验亚硫酸钠是否变质 | 先将亚酸钠样品溶于水配成溶液,然后加入足量稀盐酸酸化,再加入Ba(NO3)2溶液观察是否生成白色沉淀观察是否产生白色沉淀 |
| B | 除去苯中混有的苯酚 | 加入适量的溴水充分反应后过滤弃去沉淀 |
| C | 除去NaCl晶体中少量的KNO3杂质 | 先将晶体溶于水配成溶液,然后蒸发结晶并趁热过滤弃去滤液 |
| D | 检验CH3CH2Br中存在的溴元素 | 将CH3CH2Br与NaOH溶液共热,冷却后,取出上层水溶液,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
13.工业甲醛(HCHO)含量测定的一种方法是:在甲醛的水溶液中加入过氧化氢,将甲醛氧化为甲酸,然后用已知浓度的氢氧化钠溶液滴定,(已知H2O2也能氧化甲酸HCOOH)
①HCHO+H2O2→HCOOH+H2O△H<0
②NaOH+HCOOH→HCOONa+H2O△H<0
下列有关说法正确的是( )
①HCHO+H2O2→HCOOH+H2O△H<0
②NaOH+HCOOH→HCOONa+H2O△H<0
下列有关说法正确的是( )
| A. | 测定时可用氯水代替过氧化氢氧化甲醛 | |
| B. | 足量H2O2氧化1molHCHO时放出的热量一定是①的2倍 | |
| C. | 上述方法测定甲醛含量时,如果H2O2过量,会导致甲醛含量的测定结果偏高 | |
| D. | H2O2氧化等物质的量甲醛(反应①)和甲酸时转移电子的数目相同 |
7.如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
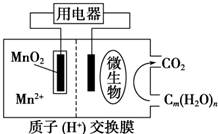

| A. | 正极反应式为MnO2+4H++2e-═Mn2++2H2O | |
| B. | 微生物所在电极区放电时发生还原反应 | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若用该电池给铅蓄电池充电,MnO2 电极质量减少8.7g,则铅蓄电池阴极增重9.6g |




 2013年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
2013年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.

