题目内容
9. 2013年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
2013年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.(1)机动车的尾气是雾霾形成的原因之一,近几年有人提出利用选择性催化剂利用汽油中挥发出来的C3H6催化还原尾气中的NO气体,请写出该过程的化学方程式:2C3H6+18NO=6CO2+6H2O+9N2
(2)我国北方到了冬季烧煤供暖所产生的废气也是雾霾的主要来源之一.经研究发现将煤炭在O2/CO2的气氛下燃烧,发现能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H
若①N2(g)+O2(g)?2NO(g)△H1=+180.5kJ•mol-1
②CO(g)?C(s)+$\frac{1}{2}$O2(g)△H2=+110.5kJ•mol-1
③C (s)+O2(g)?CO2(g)△H3=-393.5kJ•mol-1
则△H=-746.5kJ•mol-1.
(3)燃煤尾气中的SO2用NaOH溶液吸收形成NaHSO3溶液,在pH为4~7之间时电解,硫元素在铅阴极上被电解还原为Na2S2O4.Na2S2O4俗称保险粉,广泛应用于染料、印染、造纸、食品工业以及医学上.这种技术是最初的电化学脱硫技术之一.请写出该电解反应中阴极的电极方程式:2HSO3-+2H++2e-=S2O42-+2H2O
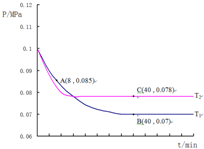
(4)SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)?2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
①该反应的化学平衡常数表达式:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$
②图中A点时,SO2的转化率为45%
③计算SO2催化氧化反应在图中B点的压强平衡常数K=24300 (Mpa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④若在T2℃,其他条件不变的情况下测得压强的变化曲线如图所示,则T1<T2(填“>”、“<”、“=”);其中C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)>vA逆) (填“>”、“<”、“=”).
分析 (1)C3H6催化还原尾气中的NO气体,可以得到无毒的气体氮气和二氧化碳;
(2)②×2+③×2-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g),据此计算反应的焓变;
(3)电解反应中阴极上发生得电子的还原反应,根据反应原理来回答书写;
(4)①反应平衡常数K=$\frac{产物平衡浓度系数次幂之积}{反应物平衡浓度系数次幂之积}$;
②结合化学三行计算列式,依据图中A点时,气体物质的量0.085,依据开始和A点气体物质的量之比列式计算,转化率=$\frac{变化量}{起始量}$×100%;
③图中B点,依据化学三行列式计算用平衡分压代替平衡浓度计算,分压=总压×物质的量分数计算SO2催化氧化反应在图中B点的压强平衡常数;
④先拐先平温度高,达到平衡所需时间短,温度越高反应速率越大.
解答 解:(1)C3H6催化还原尾气中的NO气体,可以得到无毒的气体氮气和二氧化碳,即2C3H6+18NO=6CO2+6H2O+9N2;故答案为:2C3H6+18NO=6CO2+6H2O+9N2;
(2))②×2+③×2-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g),反应的焓变=2(+110.5kJ•mol-1)+2(-393.5kJ•mol-1)-(180.5kJ•mol-1)=-746.5kJ•mol-1,故答案为:-746.5kJ•mol-1;
(3)电解反应中阴极上发生得电子的还原反应,2HSO3-+2H++2e-=S2O42-+2H2O,故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
(4)①2SO2(g)+O2(g)?2SO3,反应的平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$,
故答案为:$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$;
②依据化学三行列式计算,设氧气消耗物质的量为x,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
变化量(mol) 2x x 2x
平衡量(mol)2a-2x a-x 2x
图中A点时,气体物质的量0.085,则$\frac{2a-2x+a-x+2x}{2a+a}$=$\frac{0.085}{0.1}$,x=0.45a
SO2的转化率=$\frac{0.45a×2}{2a}$×100%=45%,
故答案为:45%;
③图中B点,依据化学三行列式计算,设氧气消耗物质的量为y,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
变化量(mol) 2y y 2y
平衡量(mol)2a-2y a-y 2y
B点气体物质的量为 0.007,则$\frac{2a-2y+a-y+2y}{2a+a}$=$\frac{0.07}{0.1}$,y=0.9a,
平衡常数K=($\frac{(0.007×\frac{1.8}{0.2a+0.1a+1.8a})^{2}}{(0.007×\frac{0.2a}{0.2a+0.1a+1.8a})^{2}×(0.007×\frac{0.1a}{0.2a+0.1a+1.8a})}$)=24300(MPa)-1,
故答案为:24300(MPa)-1;
④图象分析可知,先拐先平温度高则T1<T2,C点是平衡状态,A点反应未达到平衡状态,其中C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系为vC(正)>vA(逆)
故答案为:<,>.
点评 本题考查了化学平衡、化学反应速率影响因素的分析应用,图象变化和数值的计算是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 1个氖原子 Na | B. | +2价的铁元素 Fe+2 | ||
| C. | 2个氢分子 2H | D. | 4个铵根离子 4NH4+ |
| A. | N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=+534 kJ•mol-1 | |
| B. | N2H4(l)+O2(g)═N2(g)+2H2O(g);△H=-534 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(l);△H=-534 kJ•mol-1 | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(l);△H=-622 kJ•mol-1 |

| A. | 分子式为C10H19O | |
| B. | 同分异构体可能属于醛类、酮类或酚类 | |
| C. | 能发生取代、氧化、还原反应 | |
| D. | 与氢气加成后的产物有4种一氯化物 |
| A. | 3.2 g CH30H含有的化学键数为0.4NA | |
| B. | 0.1 mol FeCl3水解制得的Fe( OH)3胶体中胶粒数是0.1NA | |
| C. | 标准状况下,2.24 L Cl2溶于足量水,转移的电子数为0.1NA | |
| D. | 0.2 g D216O中含有的质子数、中子数和电子数均为0.1NA |
| A. | 1 mol-OH(羟基)与l mol NH4+中所含电子数均为10NA | |
| B. | 25℃时,100 mL pH=l的稀硫酸中,含有的H+数目为0.01 NA | |
| C. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1 NA | |
| D. | 标准状况下,2.24LNO2和N2O4混合气体中含0.2 NA个氧原子 |
 请根据所学化学反应原理,解决以下问题:
请根据所学化学反应原理,解决以下问题: 是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如所示:
是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如所示:
 $→_{△}^{H_{2}O/H+}$
$→_{△}^{H_{2}O/H+}$
 .
. $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +H2O.
+H2O. ,与D互为同分异构体且含有碳碳双键的苯的二取代物有6种,其中核磁共振氢谱为5组峰,且峰面积比为2:1:2:2:1的结构简式是
,与D互为同分异构体且含有碳碳双键的苯的二取代物有6种,其中核磁共振氢谱为5组峰,且峰面积比为2:1:2:2:1的结构简式是 (任写一种).
(任写一种). )的
)的