题目内容
11.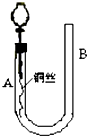 为了说明稀硝酸与铜反应产生无色的一氧化氮气体,某同学设计了如图所示的实验装置.实验时,将分液漏斗的活塞打开,从U形管的长管口B注入稀硝酸,一直到U形管的短管口A单孔塞下沿且液面不再留有气泡为止.关闭活塞,并用酒精灯在U形管短管下微热.当铜丝上有气泡产生时,立即撤去酒精灯.试回答:
为了说明稀硝酸与铜反应产生无色的一氧化氮气体,某同学设计了如图所示的实验装置.实验时,将分液漏斗的活塞打开,从U形管的长管口B注入稀硝酸,一直到U形管的短管口A单孔塞下沿且液面不再留有气泡为止.关闭活塞,并用酒精灯在U形管短管下微热.当铜丝上有气泡产生时,立即撤去酒精灯.试回答:(1)反应一段时间后,除了可以观察到铜丝逐渐溶解,有气泡产生,还会出现的现象有溶液逐渐变蓝;A处液面下降,B处液面上升.
(2)反应结束后,若将活塞缓缓打开,分液漏斗内有何现象U型管B侧管中硝酸又回落到A侧管内,分液漏斗中有红棕色气体出现.
(3)写出生成一氧化氮的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
分析 由图可知,关闭活塞,并用酒精灯在U形管短管下微热,发生Cu与稀硝酸的反应生成硝酸铜和NO,若将活塞缓缓打开,NO进入分液漏斗内,以此来解答.
解答 解:(1)关闭活塞,并用酒精灯在U形管短管下微热,发生Cu与稀硝酸的反应生成硝酸铜和NO,反应一段时间观察到U型管内因不溶性气体NO的生成而产生压强差,所以A处液面下降,B处液面上升,反应生成硝酸铜,溶液颜色变为蓝色,
故答案为:U溶液逐渐变蓝;A处液面下降,B处液面上升;
(2)如果再将分液漏斗的活塞慢慢打开,右侧压强大于左侧,U型管B侧管中硝酸又回落到A侧管内,NO与空气接触而生成红棕色气体.
故答案为:U型管B侧管中硝酸又回落到A侧管内,分液漏斗中有红棕色气体出现;
(3)金属铜可以和稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
点评 本题考查性质实验方案的设计,把握发生的反应及NO的性质为解答的关键,侧重分析与实验能力的考查,注意分液漏斗中有空气,题目难度中等.

练习册系列答案
相关题目
2.下列实验操作正确的是( )
| A. | 配制银氨溶液:向2%的稀氨水中滴入2%的硝酸银溶液,配得银氨溶液 | |
| B. | 实验室制硝基苯:试剂顺序--先加浓H2SO4,再加浓HNO3混合冷却后,最后加苯 | |
| C. | 检验卤代烃消去反应的有机产物:溴乙烷和NaOH的乙醇溶液混合后加热,将产生的蒸汽直接通入酸性高锰酸钾溶液,观察是否褪色 | |
| D. | 鉴别矿物油和植物油:向汽油和植物油中分别加入一定量NaOH溶液加热振荡,观察油层是否消失或变薄 |
6.如图是氯化钠晶体和二氧化碳晶体的结构示意图,关于两种晶体说法正确的是( )
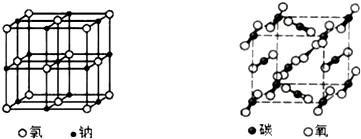

| A. | 两种晶体内均含有共价键 | B. | 构成两种晶体的微粒均是原子 | ||
| C. | 两者的硬度、熔沸点差别较大 | D. | 两种晶体均属于离子晶体 |
16.25℃时,在某澄清透明酸性溶液中,则在此溶液中还能大量共存的离子组有( )
| A. | Na+、Fe2+、NO3- | B. | K+、ClO-、SO42- | ||
| C. | NH4+、HCO3-、AlO2- | D. | Cu2+、Mg2+、Cl- |
9.设NA为阿伏伽德罗常数,下列叙述不正确的是( )
| A. | 一定条件下,180g淀粉水解得到葡萄糖的分子数为NA | |
| B. | 1 mol C10H22分子中共价键总数为31 NA | |
| C. | 室温下,4.4 g乙醛和乙酸乙酯的混合物含有的碳原子数为0.2 NA | |
| D. | 88.0g干冰中含有的共用电子对对数为8NA |
10.根据下列事实:
①在溶液中,A+N2+═A2++N;
②D+2H2O═D(OH)2+H2↑;
③以B、E为电极与E的盐溶液组成原电池,电极反应为:M2++2e-═M,N-2e-═N2+.
下列各项比较关系正确的是( )
①在溶液中,A+N2+═A2++N;
②D+2H2O═D(OH)2+H2↑;
③以B、E为电极与E的盐溶液组成原电池,电极反应为:M2++2e-═M,N-2e-═N2+.
下列各项比较关系正确的是( )
| A. | 还原性:D>M>N>A | B. | 反应②中H2是氧化产物 | ||
| C. | 金属性:A>N>D>M | D. | 氧化性:M2+>N2+>A2+>D2+ |

 ;
;