题目内容
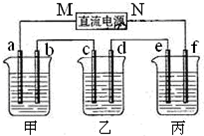
10.根据下列事实:①在溶液中,A+N2+═A2++N;
②D+2H2O═D(OH)2+H2↑;
③以B、E为电极与E的盐溶液组成原电池,电极反应为:M2++2e-═M,N-2e-═N2+.
下列各项比较关系正确的是( )
| A. | 还原性:D>M>N>A | B. | 反应②中H2是氧化产物 | ||
| C. | 金属性:A>N>D>M | D. | 氧化性:M2+>N2+>A2+>D2+ |
分析 氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,原电池中失去电子的还原性强,得到电子的氧化性强,结合元素的化合价变化判断.
解答 解:由①在溶液中,A+N2+═A2++N,可知还原性A>N,氧化剂为N2+>A2+;
②D+2H2O═D(OH)2+H2↑,可知D的还原性强,易与水反应;
③以B、E为电极与E的盐溶液组成原电池,电极反应为:M2++2e-═M,N-2e-═N2+,可知,还原性N>M,氧化性为M2+>N2+,
综上所述,还原性与金属性均为D>A>N>M,氧化性为M2+>N2+>A2+>D2+,反应②中H得到电子,被还原,则H2是还原产物,
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中氧化性、还原性的比较方法为解答的关键,侧重分析与应用能力的考查,注意化合价变化的判断及应用,题目难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
18.下列说法不正确的是( )
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 化学反应的速率和限度均可通过改变化学反应条件而改变 | |
| C. | 可逆反应只是代表少数反应 | |
| D. | 化学反应达到平衡状态时,正反应速率与逆反应速率相等 |
5.下列叙述正确的是( )
①热稳定性:H2O>HF>H2S
②SrSO4是难溶于水的白色固体
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤因为常温下白磷可自然,而氮气须在放电时才与氧气反应,所以非金属性:P>N
⑥Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱.
①热稳定性:H2O>HF>H2S
②SrSO4是难溶于水的白色固体
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤因为常温下白磷可自然,而氮气须在放电时才与氧气反应,所以非金属性:P>N
⑥Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱.
| A. | 只有②④ | B. | 只有①⑤⑥ | C. | 只有②④⑥ | D. | 只有③⑤ |
19.下列反应中,属于取代反应的是( )
| A. | 乙烯使酸性高锰酸钾溶液褪色 | B. | 乙烷在空气中燃烧 | ||
| C. | 乙烯使氯水褪色 | D. | 乙烷与氯气在光照下颜色变浅 |
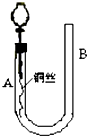 为了说明稀硝酸与铜反应产生无色的一氧化氮气体,某同学设计了如图所示的实验装置.实验时,将分液漏斗的活塞打开,从U形管的长管口B注入稀硝酸,一直到U形管的短管口A单孔塞下沿且液面不再留有气泡为止.关闭活塞,并用酒精灯在U形管短管下微热.当铜丝上有气泡产生时,立即撤去酒精灯.试回答:
为了说明稀硝酸与铜反应产生无色的一氧化氮气体,某同学设计了如图所示的实验装置.实验时,将分液漏斗的活塞打开,从U形管的长管口B注入稀硝酸,一直到U形管的短管口A单孔塞下沿且液面不再留有气泡为止.关闭活塞,并用酒精灯在U形管短管下微热.当铜丝上有气泡产生时,立即撤去酒精灯.试回答: 利用所学化学知识解答问题:
利用所学化学知识解答问题: