题目内容
3.(1)某学生进行中和热测定,取用50mL0.50mol•L-1的HCl和50mL0.55mol•L-1的Na0H溶液(密度都是1g.cm-3).实验后得到以下数据:| 起始温度T1/℃ | 终止温度T2/℃ | 温度差(T2-T1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)该学生测得的数据比理论值低(填“高”或“低”).
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母)AB.
A.溶液混合后未及时盖好热计杯盖 B.倾倒溶液太快,有少量溅出烧杯.
分析 (1)先判断数据的有效性,然后计算出平均温度差,再根据Q=cm△T计算出反应放出的热量,最后计算出中和热;
(2)中和热是57.3kJ•mol-1;
(3)A.装置保温、隔热效果差,测得的热量偏小;
B.倾倒溶液太快,有少量溅出烧杯,放出热量偏小.
解答 解:(1)第3次得到温度差误差较大,应该舍弃,所以平均温度差为$\frac{3.25℃+3.00℃}{2}$=3.125℃,50mL0.50mol•L-1的HCl和50mL0.55mol•L-1的Na0H溶液的质量m=100mL×1g/cm3=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.125℃=1.30625kJ,即生成1mol的水放出热量为=$\frac{1.30625kJ}{0.025}$=52.25kJ,即该实验测得的中和热△H=-52.25kJ/mol;
故答案为:-52.25kJ/mol;
(2)该学生测得的中和热是52.25kJ/mol;而中和热是57.3kJ•mol-1,则学生测得的数据比理论值低;
故答案为:低;
(3)A.装置保温、隔热效果差,测得的热量偏小,所以测得中和热的数值偏小,故A正确;
B.倾倒溶液太快,有少量溅出烧杯,放出热量偏小,所以测得中和热的数值偏小,故B正确;
故选AB.
点评 本题主要考查反应热的测定与计算,题目难度大,注意理解中和热的概念以及测定反应热的误差等问题.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
14.下列有关叙述正确的是( )
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝 | |
| C. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学,使光学显微镜分辨率步入纳米时代.利用此类光学显微镜可以具有丁达尔效应的分散系中分散质 | |
| D. | 酸碱指示剂变色、煤的液化、海水提取溴、焰色反应都涉及化学变化 |
8.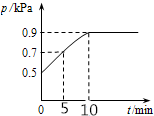 在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
 在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 该温度下此反应的平衡常数K=0.64mol/L | |
| B. | 从反应开始到t1时的平均反应速率v(X)=0.008mol/(L•min) | |
| C. | 欲提高平衡体系中Y的体积分数,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
1.下列物质属于碱的是( )
| A. | Na2CO3 | B. | NaOH | C. | HCl | D. | BaSO4 |
 与
与
 和
和
 和
和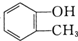
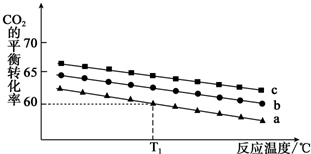
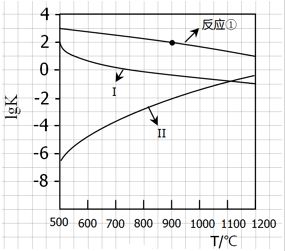 用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.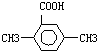 .
.