题目内容
18.不能证明HA是弱酸的是( )| A. | 0.01 mol•L-1HA溶液的pH=4 | B. | HA溶液跟锌反应,放出H2很慢 | ||
| C. | pH=2的HA溶液稀释100倍后pH=3.5 | D. | 溶液中存在HA的电离平衡 |
分析 要证明一元酸HR为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
解答 解:A.常温下,测得0.01 mol/LHA溶液的pH=4,说明HA没有完全电离,可证明HA为弱酸,故A不选;
B.HA溶液跟锌反应,生成氢气的快慢与溶液的浓度有关,不能根据放出H2很慢,判断为弱酸,如果是强酸浓度很小生成氢气的速率也很小,故B选.
C.常温下,将pH=2的HA溶液稀释100倍,测得pH=3.5,说明加水稀释促进电离,如为强酸,稀释后pH=4,所以可证明为弱酸,故C不选;
D.溶液中存在HA的电离平衡,说明HA为弱酸不能完全电离,故D不选;
故选B.
点评 本题考查实验方案的评价,侧重于弱酸的实验角度的探究,注意把握实验原理和角度,学习中注意相关基础知识的积累,题目难度不大.

练习册系列答案
相关题目
12.溶液与人类的生活息息相关,溶液的配制是日常生活和科学实验中的常见操作.下表是硫酸溶液和氨水的密度及其溶质质量分数对照表(20℃).请仔细分析列式计算:
(1)取12%的硫酸溶液100毫升可配制成6%的硫酸溶液多少克?
(2)向200毫升28%的氨水中加入240毫升水,摇匀,所得溶液体积是多少毫升?(结果保留一位小数)
| 溶液中溶质质量分数 | 4% | 12% | 16% | 24% | 28% |
| 硫酸溶液的密度/(克/厘米3) | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度/(克/厘米3) | 0.98 | 0.95 | 0.94 | 0.91 | 0.90 |
(2)向200毫升28%的氨水中加入240毫升水,摇匀,所得溶液体积是多少毫升?(结果保留一位小数)
9.已知元素的某种性质“x”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出13种元素的x的数值:
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的x差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中的化学键类型是共价键.
(2)根据上表给出的数据,简述主族元素的x的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强).
(3)简述第二周期元素(除稀有气体外)的x的数值大小与原子半径之间的关系:原子半径越小,X的数值越大.
(4)请你预测Br与I元素的x数值的大小关系:Br>I(填“>”、“=”或“<”).
(5)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于N原子(填元素符号).
| 元素 | Al | B | Be | C | Cl | F | Li |
| x的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| x的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
(1)经验规律告诉我们:当形成化学键的两原子相应元素的x差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中的化学键类型是共价键.
(2)根据上表给出的数据,简述主族元素的x的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强).
(3)简述第二周期元素(除稀有气体外)的x的数值大小与原子半径之间的关系:原子半径越小,X的数值越大.
(4)请你预测Br与I元素的x数值的大小关系:Br>I(填“>”、“=”或“<”).
(5)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于N原子(填元素符号).
6.下列有关化学键的叙述,正确是的( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 含活泼金属元素的化合物一定不是共价化合 | |
| D. | 含有共价键的化合物一定是共价化合物 |
13.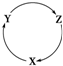 下表各组物质中,不满足下图物质一步转化关系的选项是( )
下表各组物质中,不满足下图物质一步转化关系的选项是( )
 下表各组物质中,不满足下图物质一步转化关系的选项是( )
下表各组物质中,不满足下图物质一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | NO2 | HNO3 | NO |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | Al2O3 | NaAlO2 | Al(OH)3 |
| D | SiO2 | Na2SiO3 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
10.下列各组物质中属于同分异构体的是( )
| A. | 葡萄糖和果糖 | B. | 甲烷和乙烷 | C. | 16O和18O | D. | 淀粉和纤维素 |
7.元素周期表是学习化学的重要工具,它隐含着周期表中所反映的许多信息和规律.下表所列是五种短周期的原子半径及主要化合价
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分).
(2)B元素处于周期表中三周期ⅢA族;
(3)在元素周期表中金属与非金属的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(5)用电子式表示A、D形成化合物的过程 ;
;
(6)C、E形成化合物为SO2、SO3(填化学式).
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(3)在元素周期表中金属与非金属的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(5)用电子式表示A、D形成化合物的过程
 ;
;(6)C、E形成化合物为SO2、SO3(填化学式).
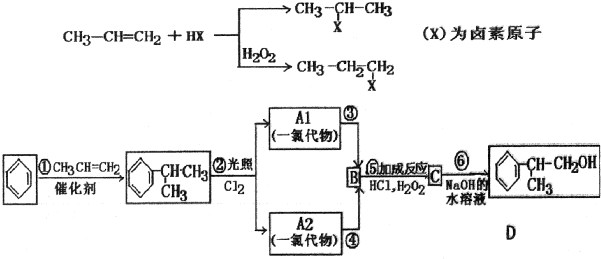
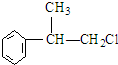 、,
、,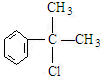 ;
; ,C的结构简式:
,C的结构简式: ;
; +NaCl;
+NaCl;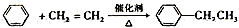

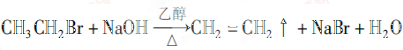 .
.