题目内容
13.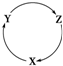 下表各组物质中,不满足下图物质一步转化关系的选项是( )
下表各组物质中,不满足下图物质一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | NO2 | HNO3 | NO |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | Al2O3 | NaAlO2 | Al(OH)3 |
| D | SiO2 | Na2SiO3 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 物质转化关系为X→Y→Z→X,物质性质分析判断,
A.NO2和水反应生成硝酸,硝酸和铜反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮;
B.铜和浓硫酸加热反应生成硫酸铜,硫酸铜和氢氧化钠溶液生成氢氧化铜沉淀,氢氧化铜不能一步反应生成铜;
C.Al2O3和氢氧化钠溶液反应生成偏铝酸钠,偏铝酸钠溶液通入二氧化碳生成氢氧化铝沉淀,氢氧化铝分解生成氧化铝;
D.二氧化硅和氢氧化钠溶液反应生成硅酸钠溶液,硅酸钠溶液和盐酸反应生成硅酸,硅酸分解生成二氧化硅;
解答 解:A.NO2$\stackrel{O_{2}}{→}$HNO3$\stackrel{Cu}{→}$NO$\stackrel{O_{2}}{→}$NO2,故A不符合;、
B.Cu$\stackrel{浓硫酸加热}{→}$CuSO4$\stackrel{NaOH}{→}$Cu(OH)2,氢氧化铜不能一步转化为铜,故B符合;
C.Al2O3和$\stackrel{NaOH}{→}$NaAlO2$\stackrel{CO_{2}+H_{2}O}{→}$Al(OH)3$\stackrel{△}{→}$Al2O3,故C不符合;
D.SiO2$\stackrel{NaOH}{→}$Na2SiO3$\stackrel{HCl}{→}$H2SiO3$\stackrel{△}{→}$SiO2,故D不符合;
故选B.
点评 本题考查了常见物质性质的分析,主要是单质化合物性质和转化关系的理解应用,题目较简单.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
4.X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述正确的是( )
| A. | X与Y能形成两种常见的气态化合物 | |
| B. | 原子半径的大小顺序:r(X)>r(Y)>r(Z)>r(R) | |
| C. | X、Z分别与R形成的化合物中化学键类型相同 | |
| D. | 含有Y、Z、R三种元素的化合物最多只有2种 |
8.下列结论正确的是
①微粒半径:S2->Cl->F ②氢化物的稳定性:HF>HCl>H2S>H2Te
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥非金属性:F>Cl>S>Se( )
①微粒半径:S2->Cl->F ②氢化物的稳定性:HF>HCl>H2S>H2Te
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥非金属性:F>Cl>S>Se( )
| A. | ①②④⑥ | B. | ①③④ | C. | ①③ | D. | ⑤⑥ |
18.不能证明HA是弱酸的是( )
| A. | 0.01 mol•L-1HA溶液的pH=4 | B. | HA溶液跟锌反应,放出H2很慢 | ||
| C. | pH=2的HA溶液稀释100倍后pH=3.5 | D. | 溶液中存在HA的电离平衡 |
5.结构为…-CH2-CH=CH-CH2-CH2-CH=CH-CH2-…的高分子化合物的单体是( )
| A. | 1,3-丁二烯 | B. | 乙烯 | C. | 丙烯 | D. | 乙炔 |
2.相同温度下,相同物质的量浓度的四种溶液:①CH3COONa,②NaHSO4,③NaCl,④ .按pH值由大到小顺序排列正确的是( )
.按pH值由大到小顺序排列正确的是( )
 .按pH值由大到小顺序排列正确的是( )
.按pH值由大到小顺序排列正确的是( )| A. | ④①③② | B. | ①④③② | C. | ①②③④ | D. | ④③②① |
3.下列说法正确的是( )
| A. | 非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价 | |
| B. | 只有非金属元素才能形成含氧酸盐 | |
| C. | 主族元素中的金属元素形成的最高价阳离子一定与上一周期稀有气体元素的原子核外电子排布相同 | |
| D. | 非金属元素的最高价含氧酸都具有强氧化性 |