题目内容
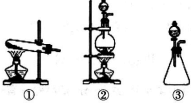
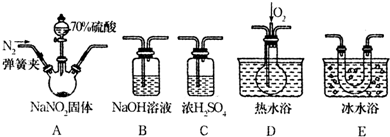
14.在实验室可用图1所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
图中:①为氯气发生装置;
②的试管里盛有15mL30%KOH 溶液.并置于热水浴中;
③的试管里盛有15mL 8% NaOH 溶液.并置于冰水浴中;
④的试管里加有紫色石蕊溶液; ⑤为尾气吸收装置.
请填写下列空白:
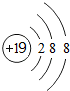
(l)写出钾离子的结构示意图
 .
.(2)制取氯气时,在烧瓶里加入一定量的二氧化锰,向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有B(选填下列字母)的净化装置.
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:制取温度不同、制取时碱的浓度也不同.反应完毕经冷却后,②的试管中有大量晶体析出,分离出该晶体的方法是过滤(填写实验操作名称).图2中符合该晶体溶解度曲线的是M(填写编号)
(4)本实验中制取次氯酸钠的离子方程式是:Cl2+2OH-=Cl-+ClO-+H2O
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为浅黄绿色 | 继续通入的氯气溶于水使溶液呈浅黄绿色 |
分析 (l)钾离子核内有19个质子,核外有18个电子,每层上的电子数为2、8、8,据此画离子结构示意图;
(2)实验室中用浓盐酸与二氧化锰加热反应制取氯气,氯气中含有氯化氢杂质,可用饱和食盐水除去氯气中的氯化氢气体;
(3)由题目信息可知,在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠;分离固体与液体通常采用过滤的方法;②的试管中有大量晶体析出,说明溶质的溶解度随温度的降低而降低,据此进行判断;
(4)本实验中用氯气与8% NaOH 溶液,并置于冰水浴中,制取次氯酸钠,据此书写离子方程式;
(5)氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质;氯气溶于水后呈浅黄绿色;
解答 解:(l)钾离子核内有19个质子,核外有18个电子,每层上的电子数为2、8、8,钾离子结构示意图为 ,
,
故答案为: ;
;
(2)实验室中用浓盐酸与二氧化锰加热反应制取氯气,氯气中含有氯化氢杂质,可用饱和食盐水除去氯气中的氯化氢气体,用饱和食盐水除去氯气中的氯化氢气体,故在①与②之间安装盛有饱和食盐水的洗气瓶,所以B正确,
故选B;
(3)根据题中信息可知,在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,二者反应的浓度和温度都不相同;不溶性固体与液体的分离常采用过滤的方法,反应完毕经冷却后,②的试管中有大量晶体析出,说明溶质的溶解度随温度的降低而降低,只有M符合,
故答案为:制取温度不同、制取时碱的浓度也不同;过滤;M;
(4)本实验中用氯气与8% NaOH 溶液,并置于冰水浴中,制取次氯酸钠,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色;氯气与水反应生成的HClO,次氯酸具有强氧化性,将石蕊氧化为无色物质;多余的氯气溶于水,使溶液呈浅黄绿色,
故答案为:
| 红 | |
| 氯气与水反应生成的HClO将石蕊氧化为无色物质 | |
| 浅黄绿 | 继续通入的氯气溶于水使溶液呈浅黄绿色 |
点评 本题考查对装置的分析评价、物质的分离提纯、对实验现象的分析等知识点,试题难度中等,该类试题综合性强,难易适中,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力;该类试题主要是以常见仪器的选用、实验基本操作为中心,重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力.

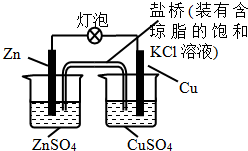
| A. | 一段时间后,铜棒上有红色物质析出 | |
| B. | 正极反应为:Zn-2e-=Zn2+ | |
| C. | 在外电路中,电流从锌棒流向铜棒 | |
| D. | 盐桥中的K+移向ZnSO4溶液 |
| A. | Fe3O4 | B. | Na2O2 | C. | SO2 | D. | NO2 |
| A. | 直接用酒精喷灯加热 | B. | KMnO4、铝条 | ||
| C. | 火柴头、浓盐酸 | D. | KMnO4、鞭炮引线 |
 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.