题目内容
12.下列离子方程式中,正确的是( )| A. | 钠放入水中 Na+H2O═Na++OH-+H2↑ | |
| B. | 电解饱和食盐水 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 实验室用氯化铝溶液和氨水制氢氧化铝 Al3++3OH-═Al(OH)3↓ | |
| D. | 向碳酸氢铵溶液中加入足量氢氧化钠溶液 HCO3-+OH-═CO32-+H2O |
分析 A.原子个数不守恒;
B.电解饱和食盐水生成氢气、氯气和氢氧化钠;
C.一水合氨为弱碱,应保留化学式;
D.漏掉氨根离子与氢氧根离子的反应.
解答 解:A.钠放入水中,离子方程式:2 Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.电解饱和食盐水,离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,故B正确;
C.实验室用氯化铝溶液和氨水制氢氧化铝,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C错误;
D.向碳酸氢铵溶液中加入足量氢氧化钠溶液,离子方程式:NH4++HCO3-+2OH-═CO32-+H2O+NH3•H2O,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
2.能用酸性高锰酸钾溶液鉴别的一组物质是( )
| A. | 苯 己烷 | B. | 苯 甲苯 | C. | 乙烷 丙烷 | D. | 乙烯 乙炔 |
3.如图是喷泉实验装置图,下列说法正确的是( )


| A. | 烧瓶中的溶液呈红色,则原气体一定是SO2 | |
| B. | 形成喷泉的原因是烧瓶内压强小于外界大气压 | |
| C. | 烧瓶中的溶液呈蓝色,则原气体一定属于是碱类物质 | |
| D. | 若将石蕊改成氢氧化钠,则CO、CO2均能形成喷泉 |
20.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 柠檬属于酸性食物 | |
| B. | 油脂是人类维持生命活动所需能量的主要来源 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性 |
7.已知:①2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1②氢气燃烧的能量变化示意图:
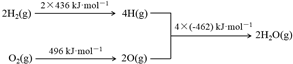
下列说法正确的是( )

下列说法正确的是( )
| A. | 1molC(s)完全燃烧放出110 kJ的热量 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-480 kJ•mol-1 | |
| C. | C(s)+H2O(g)═CO(g)+H2(g)△H=+130 kJ•mol-1 | |
| D. | 欲分解2 mol H2O(l),至少需要提供4×462 kJ的热量 |
17. 用下列装置(尾气处理已略去)进行相关实验,能实现实验目的是( )
用下列装置(尾气处理已略去)进行相关实验,能实现实验目的是( )
 用下列装置(尾气处理已略去)进行相关实验,能实现实验目的是( )
用下列装置(尾气处理已略去)进行相关实验,能实现实验目的是( )| 实验目的 | a中试剂 | b中试剂 | c中试剂 | |
| A | 比较H2CO3、H2SiO3 的酸性 | 醋酸溶液 | 碳酸钠 | 硅酸钠溶液 |
| B | 比较Cl2、I2的 氧化性 | 浓盐酸 | 高锰酸钾 | 碘化钾溶液 |
| C | 制备NaHCO3 | 盐酸 | 大理石 | 饱和碳酸钠溶液 |
| D | 证明C2H2有还原性 | 饱和食盐水 | 电石 | 酸性高锰酸钾溶液 |
| A. | A | B. | B | C. | C | D. | D |
4.下列关于容量瓶的使用方法中,正确的是( )
| A. | 使用前检查是否漏水 | B. | 溶液未冷却即注入容量瓶中 | ||
| C. | 容量瓶可长期存放溶液 | D. | 在容量瓶中直接溶解固体 |
1.不同镜子背后的金属镀层可能是不同的,目前使用的金属主要有两种.为研究金属镀层的成分,某小组分别收集了两块镜子背面的金属镀层粉末甲和乙,按下述实验操作步骤进行实验:
根据实验,回答下列问题:
(1)甲与浓硝酸反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(2)实验操作⑤的实验现象是白色沉淀溶解,乙溶解在NaOH溶液中反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)欲“比较甲和乙的金属活动性顺序”,实验的操作步骤是将打磨后的铝条插入硝酸银溶液中.
| 金属 | 实验操作 | 实验现象 |
| 甲 | ①取少量粉末,加入过量浓硝酸 ②向上述溶液中加入几滴NaCl溶液 | 粉末溶解,有红棕色气体产生 有白色沉淀生成 |
| 乙 | ③取少量粉末,加入足量NaOH溶液 ④向上述溶液中逐滴加入稀盐酸 ⑤继续加入过量的稀盐酸 | 粉末溶解,有气泡产生 有白色沉淀生成 白色沉淀溶解 |
(1)甲与浓硝酸反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(2)实验操作⑤的实验现象是白色沉淀溶解,乙溶解在NaOH溶液中反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑.
(3)欲“比较甲和乙的金属活动性顺序”,实验的操作步骤是将打磨后的铝条插入硝酸银溶液中.
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1mol 18O含有的中子数为10NA | |
| B. | 22.4L甲烷气体中所含分子数目为NA | |
| C. | 1L 0.1mol•L-1NH4Cl 溶液中NH4+数目为 0.1NA | |
| D. | 1L pH=1的醋酸溶液中,CH3COOH分子的数目为0.1NA |