题目内容
7.已知:①2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1②氢气燃烧的能量变化示意图: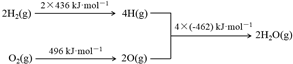
下列说法正确的是( )
| A. | 1molC(s)完全燃烧放出110 kJ的热量 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-480 kJ•mol-1 | |
| C. | C(s)+H2O(g)═CO(g)+H2(g)△H=+130 kJ•mol-1 | |
| D. | 欲分解2 mol H2O(l),至少需要提供4×462 kJ的热量 |
分析 A.1molC(s)完全燃烧生成1mol二氧化碳气体;
B.H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=(436kJ•mol-1+$\frac{1}{2}×$496kJ•mol-1)-2×(462kJ•mol-1);
C.已知:①2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1,
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-240kJ•mol-1,
根据盖斯定律可知$\frac{1}{2}×①$-②得C(s)+H2O(g)═CO(g)+H2(g)△H;
D.由示意图可知,欲分解2 mol H2O(g),至少需要提供4×462 kJ的热量.
解答 解:A.1molC(s)完全燃烧生成1mol二氧化碳气体,放出的热量大于110 kJ,故A错误;
B.H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=(436kJ•mol-1+$\frac{1}{2}×$496kJ•mol-1)-2×(462kJ•mol-1)=-240kJ•mol-1,故B错误;
C.已知:①2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1,
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-240kJ•mol-1,
根据盖斯定律可知$\frac{1}{2}×①$-②得C(s)+H2O(g)═CO(g)+H2(g)△H=$\frac{1}{2}×$(-220kJ•mol-1)-(-240kJ•mol-1)=+130 kJ•mol-1,故C正确;
D.由示意图可知,欲分解2 mol H2O(g),至少需要提供4×462 kJ的热量,故D错误;
故选C.
点评 本题考查了热化学方程式、盖斯定律的应用,难度中等,据已知反应构建所求反应方程式是解题的关键.

 阅读快车系列答案
阅读快车系列答案| A. | 氯气 | B. | 过氧化钠 | C. | 次氯酸钠 | D. | 氢氧化钠 |
| A. | 生铁 | B. | 石墨 | C. | 硅晶体 | D. | 水银 |
| A. | 溶液中所含离子的种类相同 | B. | 溶液的pH相同 | ||
| C. | 都能与盐酸反应放出CO2气体 | D. | 都能使澄清石灰水变浑浊 |
| A. | 钠放入水中 Na+H2O═Na++OH-+H2↑ | |
| B. | 电解饱和食盐水 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 实验室用氯化铝溶液和氨水制氢氧化铝 Al3++3OH-═Al(OH)3↓ | |
| D. | 向碳酸氢铵溶液中加入足量氢氧化钠溶液 HCO3-+OH-═CO32-+H2O |
| 混合物 | 试剂 | 分离方法 | |
| A | 粗苯甲酸(泥沙等) | 水 | 重结晶 |
| B | 甲烷(乙烯) | 高锰酸钾酸性溶液 | 洗气 |
| C | 乙炔(硫化氢) | 硫酸铜溶液 | 洗气 |
| D | 溴苯(溴) | 稀氢氧化钠溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
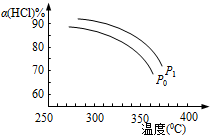 ,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
 子交换膜只允许阴离子通过,电极为惰性电极)
子交换膜只允许阴离子通过,电极为惰性电极)