题目内容
9.20℃时把一定量的20%的某物质的水溶液蒸发10g水后,再冷却到20℃时析出晶体2g(不含结晶水),此时溶液的溶质质量分数为24%,则该物质在20℃时的溶解度为( )| A. | 20g | B. | 25.4g | C. | 31.6g | D. | 34.8g |
分析 由于原溶液未指明是否饱和,故通过分析恒温蒸发水分析出的晶体后溶液变为饱和溶液,则根据所得溶液中溶质的质量分数为24%进行计算20℃时该物质的溶解度,据溶解度的定义可知溶液的溶解度.
解答 解:根据题意:20℃时所得的饱和溶液中溶质的质量分数为24%,可理解为20℃时100g某物质饱和溶液中溶质的质量为24g,
设20℃时该物质的溶解度为S,则
$\frac{24g}{(100-24)g}=\frac{S}{100g}$,解得S=31.6g,
故选C.
点评 本题考查了溶解度的计算,难度中等,利用溶解度的概念结合恒温蒸发水分的过程进行分析判断即可.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
17.下列物质的性质比较正确的是( )
| A. | 熔点:Na>Al | B. | 热稳定性NaHCO3>Na2CO3 | ||
| C. | 酸性:H2CO3>H2SiO3 | D. | 氧化性Br2>Cl2 |
4.下列说法正确的是( )
| A. | Na、Mg、Al的第一电离能逐渐增大 | B. | V、Cr、Mn的最外层电子数逐渐增大 | ||
| C. | S2-、Cl-、K+的半径逐渐减小 | D. | O、F、Ne的电负性逐渐增大 |
14.同温同压下两个体积相同的容器,一个盛NH3气体,另一个盛N2和H2的混合气体,两瓶气体一定有相同的是( )
| A. | 质量 | B. | 原子总数 | C. | 密度 | D. | 分子总数 |
1.生活中为了延长鲜花的寿命,通常会在花瓶中加入“鲜花保鲜剂”.下表是0.5L某种“鲜花保鲜剂”中含有的成分及含量.
请回答下列问题:
(1)“鲜花保鲜剂”中K+的物质的量浓度表示为$\frac{\frac{0.25g}{158g/mol}+\frac{0.25g}{174g/mol}×2}{0.5L}$(写出表达式即可,不需要化简)
(2)为了研究不同浓度的“鲜花保鲜剂”的保鲜功效,需配制多份不同物质的量浓度的
溶液进行研究.现欲配制480mL某物质的量浓度的“鲜花保鲜剂”,所需的玻璃仪器有:烧杯、玻璃棒、胶头滴管、500mL容量瓶.
(3)配制上述“鲜花保鲜剂”时,其正确的操作顺序是(每个操作只用一次):G→B→C→A→F→E→D.
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入适量水溶解
C.将烧杯中的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀,装入贴有标签的试剂瓶
E.改用胶头滴管加水,使溶液的凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
G.用电子天平称量各组成成分,并把它们放入烧杯中混合
(4)在溶液配制过程中,下列操作使溶液浓度偏小的是:AD.
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“鲜花保鲜剂”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线.
| 成分 | 质量(g) | 摩尔质量(g/mol) |
| 蔗糖(C12H22O11) | 25.00 | 342 |
| 硫酸钾 | 0.25 | 174 |
| 阿司匹林(C9H8O4) | 0.17 | 180 |
| 高锰酸钾 | 0.25 | 158 |
| 硝酸银 | 0.02 | 170 |
(1)“鲜花保鲜剂”中K+的物质的量浓度表示为$\frac{\frac{0.25g}{158g/mol}+\frac{0.25g}{174g/mol}×2}{0.5L}$(写出表达式即可,不需要化简)
(2)为了研究不同浓度的“鲜花保鲜剂”的保鲜功效,需配制多份不同物质的量浓度的
溶液进行研究.现欲配制480mL某物质的量浓度的“鲜花保鲜剂”,所需的玻璃仪器有:烧杯、玻璃棒、胶头滴管、500mL容量瓶.
(3)配制上述“鲜花保鲜剂”时,其正确的操作顺序是(每个操作只用一次):G→B→C→A→F→E→D.
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入适量水溶解
C.将烧杯中的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀,装入贴有标签的试剂瓶
E.改用胶头滴管加水,使溶液的凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
G.用电子天平称量各组成成分,并把它们放入烧杯中混合
(4)在溶液配制过程中,下列操作使溶液浓度偏小的是:AD.
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“鲜花保鲜剂”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线.
18.已知:2H2(g)+O2(g)═2H2O(g),△H=-483.6kJ/mol,下列说法错误的是( )
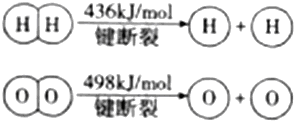

| A. | 该反应原理可用于设计氢氧燃料电池 | |
| B. | 破坏1mol H-O键需要的能量是926.8kJ | |
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.8kJ/mol | |
| D. | H2(g)中的H-H键比H2O(g)中的H-O键能小 |
19.运用相关化学知识进行判断,下列结论错误的是( )
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 |
 .
. 或
或 .
. .
.