题目内容
4.下列说法正确的是( )| A. | Na、Mg、Al的第一电离能逐渐增大 | B. | V、Cr、Mn的最外层电子数逐渐增大 | ||
| C. | S2-、Cl-、K+的半径逐渐减小 | D. | O、F、Ne的电负性逐渐增大 |
分析 A.Mg的最外层为3s电子全满,难以失去电子;
B.V、Cr、Mn的最外层电子排布遵循电子排布能量规律;
C.核外电子排布相同的微粒,原子序数越小,半径越大;
D.根据同周期元素的性质递变规律判断.
解答 解:A.Mg的最外层为3s电子全满,稳定结构,难以失去电子,第一电离能最大,Na的最小,故A错误;
B.V、Cr、Mn的最外层电子排布遵循电子排布能量规律,三者的最外层电子数均为2,故B错误;
C.由于S2-、Cl-、K+的核外电子排布相同,且原子序数越小,半径越大,故C正确;
D.O、F位于同一周期,同周期元素从左到右元素的电负性依次增大,Ne为稀有气体元素,电负性小于F,故D错误;
故选C.
点评 本题考查较为综合,涉及杂化轨道以及元素周期律的递变规律的判断,注意把握杂化轨道的判断方法和元素周期律的递变规律,题目难度不大.

练习册系列答案
相关题目
14.分子式为C5H8的有机物,不可能是( )
| A. | 只含有1个双键的直链有机物 | B. | 含有2个双键的直链有机物 | ||
| C. | 含有1个双键的环状有机物 | D. | 含有1个叁键的直链有机物 |
15.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小 | |
| D. | 在一定条件下,某可逆反应正向是吸热反应,则其逆向必是放热反应 |
12.高温下,某反应达平衡,平衡常数K=$\frac{C(CO)•C({H}_{2}O)}{C(C{O}_{2})•C({H}_{2})}$.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| A. | 该反应的△H>0 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应化学方程式CO+H2O(g)$?_{高温}^{催化剂}$CO2+H2 |
9.20℃时把一定量的20%的某物质的水溶液蒸发10g水后,再冷却到20℃时析出晶体2g(不含结晶水),此时溶液的溶质质量分数为24%,则该物质在20℃时的溶解度为( )
| A. | 20g | B. | 25.4g | C. | 31.6g | D. | 34.8g |
16.将42g纯醋酸(化学式为CH3COOH,相对分子质量为60)溶解在58g水中,形成密度为1.05g/cm3的溶液,所得溶液中醋酸的物质的量浓度为( )
| A. | 7.35 mol/L | B. | 8.70 mol/L | C. | 10.05 mol/L | D. | 11.40 mol/L |
13.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下烈说法正确的是( )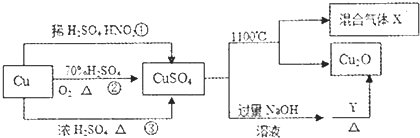

| A. | 途径①、②和③都体现了硫酸的酸性和氧化性 | |
| B. | Y可以是甲醛溶液 | |
| C. | CuSO.在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | 将CuSO4溶液蒸发浓缩、冷却结晶,因Cu2+水解得不到胆矾晶体 |
14.下列关于硅的说法,不正确的是( )
| A. | 硅的化学性质不活泼,常温下不与任何物质反应 | |
| B. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| C. | 硅是非金属元素,它的单质是灰黑色有金属光泽的固体 | |
| D. | 加热到一定温度时硅能与H2、O2等非金属反应 |
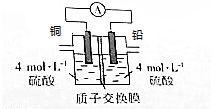 铅是一种活泼金属,铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,某同学根据反应设计如下装置:回答下列问题:
铅是一种活泼金属,铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,某同学根据反应设计如下装置:回答下列问题: