题目内容
20.下列叙述不正确的是( )| A. | 常温下,将pH=3的盐酸溶液稀释到原体积的10倍,稀释后溶液的pH=4 | |
| B. | 25℃时Ksp(AgCl)=1.8×10-10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能减小 | |
| C. | 浓度均为0.1mol•L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>NaHCO3>(NH4)2SO4>NH4Cl | |
| D. | 为确定H2A是强酸还是弱酸,可测0.1mol•L-1NaHA溶液的pH,若pH>1,则H2A是弱酸;若pH=1,则H2A是强酸 |
分析 A.强酸加水稀释到原体积的10倍,pH增大1个单位;
B.氯化银的悬浊液存在沉淀的溶解平衡,加入NaCl固体后,氯离子浓度增大;
C.根据盐类水解的酸碱性和水解程度比较;
D.NaHA在溶液中完全电离出钠离子和氢离子,则H2A为强酸.
解答 解:A.强酸加水稀释到原体积的10倍,pH增大1个单位,则常温下,将pH=3的盐酸溶液稀释到原体积的10倍,稀释后溶液的pH=4,故A正确;
B.氯化银的悬浊液存在沉淀的溶解平衡,加入NaCl固体后,氯离子浓度增大,平衡逆向移动,AgCl的溶解度减小,故B正确;
C.NaOH溶液是强碱溶液PH>7; Na2CO3溶液中碳酸根离子水解,溶液呈碱性,PH>7,碱性小于氢氧化钠溶液,NaHCO3水解程度小于碳酸钠,所以碱性Na2CO3大于NaHCO3,(NH4)2SO4和NH4Cl显酸性,(NH4)2SO4的酸性大于NH4Cl,所以溶液的pH由大到小的排列顺序为:NaOH>Na2CO3>NaHCO3>NH4Cl>(NH4)2SO4,故C错误;
D.为确定H2A是强酸还是弱酸,可测0.1mol•L-1NaHA溶液的pH,若pH>1,HA-在溶液中部分电离,则H2A是弱酸;若pH=1,HA-在溶液中完全电离,则H2A是强酸,故D正确.
故选C.
点评 本题考查较为综合,涉及弱电解质的电离、沉淀溶解平衡、酸碱的混合计算等知识,侧重于学生的分析和计算能力的考查,为高频考点,注意把握弱电解质的电离特点和影响因素,难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
10.补充完成下表:
(1)请把序号①一⑦的答案对应填上)
①Na②Cl③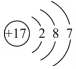 ④
④ ⑤二⑥ⅠA⑦ⅥA
⑤二⑥ⅠA⑦ⅥA
(2)甲元素最高价氧化物对应的水化物呈碱性(填“酸、碱”),乙元素的最高价氧化物对应的水化物的化学式为HClO4.
(3)甲与乙两元素的单质反应生成物的电子式为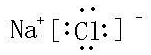 ,属于离子(离子或共价)化合物.
,属于离子(离子或共价)化合物.
(4)甲单质与丙的氢化物反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① | ② | O |
| 原子结构 示意图 |  | ③ | ④ |
| 周期 | 三 | 三 | ⑤ |
| 族 | ⑥ | ⅦA | ⑦ |
①Na②Cl③
 ④
④ ⑤二⑥ⅠA⑦ⅥA
⑤二⑥ⅠA⑦ⅥA(2)甲元素最高价氧化物对应的水化物呈碱性(填“酸、碱”),乙元素的最高价氧化物对应的水化物的化学式为HClO4.
(3)甲与乙两元素的单质反应生成物的电子式为
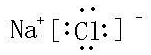 ,属于离子(离子或共价)化合物.
,属于离子(离子或共价)化合物.(4)甲单质与丙的氢化物反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
12.下列物质的用途不正确的是( )
| A. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| B. | 氧化铝可以作优良的耐火材料 | |
| C. | Fe2O3常用作红色油漆和涂料 | |
| D. | 硅是制造光导纤维的材料 |
9.下列物质能通过化合反应直接制得的是( )
①FeCl2 ②H2SiO3 ③NH4NO3 ④HCl.
①FeCl2 ②H2SiO3 ③NH4NO3 ④HCl.
| A. | ①③④ | B. | ①②③ | C. | ①② | D. | ①②③④ |
10.常温下,下列叙述正确的是( )
| A. | 某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=a+1 | |
| B. | 在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 常温下,1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8mol/L 盐酸的pH=8.0 | |
| D. | 电解质不一定导电,导电物质不一定是电解质 |