题目内容
10.XeO3是一种不稳定的物质,具有强氧化性.(1)配平反应的离子方程式:
5XeO3+6Mn2++9H2O→6MnO4-+5Xe↑+18H+
(2)反应现象为:①有气泡产生;②溶液显紫红色.
(3)被氧化的元素是Mn.
(4)将适量的XeO3投入30mL 0.1mol•L-1 Mn2+的水溶液中,刚好完全反应.
①此时转移电子总数为0.015mol.
②将反应后的溶液稀释至90mL,所得溶液的pH=1.
分析 (1)反应中Xe元素化合价由XeO3+6价降低为Xe中0价,总共降低6价,Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价,总共升高5价,化合价最小公倍数为30,故XeO3系数为5,故Mn2+系数为6,再结合原子守恒配平;
(2)反应中Mn2+转化为MnO4-,溶液显紫红色;
(3)还原剂发生氧化反应,所含元素化合价升高的物质为还原剂被氧化;
(4)①根据n=cV计算n(Mn2+),反应中Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价,转移电子物质的量为5n(Mn2+);
②根据n(Mn2+)计算生成n(H+),根据c=$\frac{n}{V}$计算c(H+),再根据pH=-lgc(H+)计算.
解答 解:(1)反应中Xe元素化合价由XeO3+6价降低为Xe中0价,总共降低6价,Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价,总共升高5价,化合价最小公倍数为30,故XeO3系数为5,故Mn2+系数为6,再结合原子守恒配平后方程式为5XeO3+6Mn2++9H2O=6MnO4-+5Xe↑+18H+,故答案为:5;6;9;6;5;18;
(2)反应中Mn2+转化为MnO4-,溶液显紫红色,故答案为:溶液显紫红色;
(3)还原剂被氧化,反应中Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价被氧化,故答案为:Mn;
(4)①n(Mn2+)=0.03L×0.1mol•L-1=0.003mol,反应中Mn元素化合价由Mn2+中+2价升高为MnO4-中+7价,转移电子物质的量为5n(Mn2+)=5×0.003mol=0.015mol,故答案为:0.015mol;
②由两方程式可知n(H+)=3n(Mn2+)=3×0.003mol=0.009mol,溶液稀释至90mL后,溶液中c(H+)=$\frac{0.009mol}{0.09L}$=0.1mol/L,故溶液的pH=-logc(H+)=-log0.1=1,故答案为:1.
点评 本题考查氧化还原反应的基本概念、配平、计算等,难度中等,注意掌握氧化还原反应配平常用的一些方法,计算中守恒思想的运用.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案| A. | 乙烯的结构式: | B. | 钠离子的结构示意图: | ||
| C. | 氢分子的电子式:H:H | D. | 氯化氢分子的电子式: |
| A. | Ca2+、Al3+、HCO3-、Cl- | B. | K+、Ba2+、Cl-、NO3- | ||
| C. | Na+、AlO2-、OH-、SO42- | D. | Na+、NH4+、Cl-、K+ |
| A. | NaOH[H2O] | B. | CuCl2[CuSO4] | C. | NaCl[NaCl] | D. | CuSO4[Cu(OH)2] |
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s)?NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaC1(s)?2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+C12(g)?2C1NO (g) K3
则K1,K2,K3之间的关系为K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$.
(2)已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O,一氧化氮的结构为N≡O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N═O |
| 键能/kJ•mol-1 | 630 | 243 | a | 607 |
(3)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
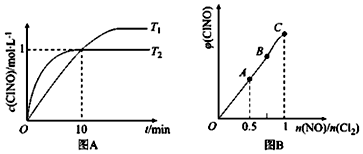
由图A可判断T1、T2温度的速率:v1<v2(“>”“<”或“=”),该反应的△H<0 (“>”“<”或“=”).
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),发生反应2NO(g)+C12(g)?2C1NO(g),平衡时ClNO的体积分数随$\frac{n(NO)}{n(C{1}_{2})}$的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是A点(“A、B、C”).
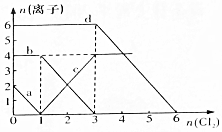 已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:
已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答: