题目内容
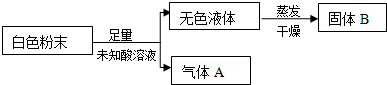
10.固体X中可能含有MgCl2、Na2CO3、K2SO3、KAlO2中的一种或几种.为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如下
根据上述实验,下列说法正确的是( )
| A. | 气体1可能为NO和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
分析 固体X中加入过量的硝酸,得溶液2,加入氯化钡生成沉淀4,说明固体中含有K2SO3,加入稀硝酸还有气体生成,则一定含有Na2CO3,向溶液2中加入氨水有沉淀生成,沉淀可能是Mg(OH)2和Al(OH)3的混合物,
向溶液2中加入氯化钡有白色沉淀生成,固体中一定含有K2SO3;
所以固体中一定含有K2SO3、Na2CO3,可能含有MgCl2、KAlO2中的一种或两种,
A、稀硝酸的强氧化性,气体1不可能为SO2;
B、沉淀3为Al(OH)3或Mg(OH)2或二者都有;
C、能和氯化钡反应产生的不溶于硝酸的白色沉淀是硫酸钡;
D、固体粉末X中一定存在Na2CO3、K2SO3,可能有MgCl2、KAlO2中的一种或两种.
解答 解:固体X中加入过量的硝酸,得溶液2,加入氯化钡生成沉淀4,说明固体中含有K2SO3,加入稀硝酸还有气体生成,则一定含有Na2CO3,向溶液2中加入氨水有沉淀生成,沉淀可能是Mg(OH)2和Al(OH)3的混合物,向溶液2中加入氯化钡有白色沉淀生成,固体中一定含有K2SO3;
所以固体中一定含有Na2CO3,可能含有Mg(OH)2和Al(OH)3中的一种或两种,
A、稀硝酸的强氧化性,气体1不可能为SO2,两者要发生氧化还原反应,稀硝酸对应产物是NO,气体1可能为NO和CO2的混合物,故A正确;
B、沉淀3为Al(OH)3或Mg(OH)2或二者都有,故B正确;
C、沉淀4可为BaSO4,故C错误;
D、固体粉末X中一定有K2SO3,可能有MgCl2、KAlO2中的一种或两种,故D正确;
故选ABD.
点评 解此类题,离子的共存问题方面进行分析,熟练掌握常见的盐的性质,而不溶于硝酸的白色沉淀只有硫酸钡和氯化银两种物质是解题的关键.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
4.在CH3COOH溶液中存在:CH3COOH?CH3COO-+H+常温下加水稀释,下列分析正确的是( )
| A. | c(OH-)减小 | B. | c(CH3COO-) 增大 | ||
| C. | pH减小 | D. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 |
5.银锌钮扣电池的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-;总反应为:Ag2O+Zn═2Ag+ZnO,下列判断正确的是( )
| A. | 锌为正极,Ag2O为负极 | B. | 锌为阳极,Ag2O为阴极 | ||
| C. | 原电池工作时,负极区PH减小 | D. | 原电池工作时,负极区PH增大 |
2.下列关于燃料电池的说法正确的是( )
| A. | 燃料电池只能在燃烧的情况下才能发生 | |
| B. | 燃料电池是将化学能转化为电能的装置 | |
| C. | 燃料电池属于二次电池的一种 | |
| D. | 燃料电池与燃料燃烧时对能量的转化率完全相同 |
5.甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成,可以发生如图转化,下列说法不正确的是( )


| A. | 在甲中滴加丁可能发生反应:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| B. | 溶液丙中还可以大量共存的离子有:I-、NO3-、SO42- | |
| C. | 白色沉淀A可能溶解在溶液D中 | |
| D. | 甲为NaHCO3,乙为 AlCl3 |
15.有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种.研究小组通过实验确定样品的成分.查阅资料知:①Cu2O+2H+═Cu+Cu2++H2O;②部分氢氧化物在溶液中沉淀的pH见表:
注:金属离子的起始浓度为0.1mol•L-1
实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀. 请回答下列问题.
(1)Ⅰ中产生气体的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是SiO2.
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是Fe2+;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是向酸性KMnO4溶液中滴加待测液,褪色.
(4)Ⅳ中加NaClO的目的是将Fe2+氧化成Fe3+,增大溶液的pH使Fe3+生成Fe(OH)3沉淀.
(5)由上述实验可以获得结论:原样品所有可能的成分组合为组合1:Al、Fe2O3、Cu2O;组合2:Al、Cu2O、Fe3O4(Al、Fe2O3、Cu2O、Fe3O4); …(用化学式表示,空不够可以补充.)
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀. 请回答下列问题.
(1)Ⅰ中产生气体的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是SiO2.
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是Fe2+;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是向酸性KMnO4溶液中滴加待测液,褪色.
(4)Ⅳ中加NaClO的目的是将Fe2+氧化成Fe3+,增大溶液的pH使Fe3+生成Fe(OH)3沉淀.
(5)由上述实验可以获得结论:原样品所有可能的成分组合为组合1:Al、Fe2O3、Cu2O;组合2:Al、Cu2O、Fe3O4(Al、Fe2O3、Cu2O、Fe3O4); …(用化学式表示,空不够可以补充.)
19.下列说法不正确的是( )
| A. | 葡萄糖属于糖类,能发生水解 | |
| B. | 甲烷是最简单的有机化合物 | |
| C. | 油脂有油和脂肪之分,但都属于脂 | |
| D. | 蛋白质、油脂、糖类是三大基本营养物质 |
20.用铂电极(惰性)电解下列溶液时,阴极和阳极的主要产物分别是H2和O2的是( )
| A. | 稀KOH溶液 | B. | HCl溶液 | C. | CuSO4溶液 | D. | NaCl溶液 |