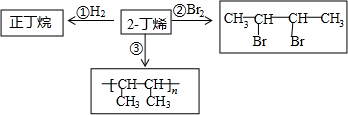
题目内容
19.如图是向MgCl2、AlCl3混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质的量y(mol) 与试剂体积V(ml)间的关系.以下结论不正确的是( )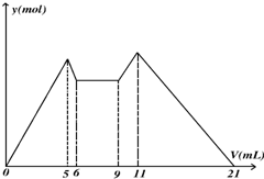
| A. | 原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 | |
| B. | A是NaOH,B是盐酸,且c(NaOH):c(HCl)=2:1 | |
| C. | 若A,B均为一元强酸或者一元强碱,则V(A):V(B)=7:13 | |
| D. | 从6到9,相应离子反应式H++OH-═H2O |
分析 根据图象知,MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,加入A立即产生沉淀,NaOH和MgCl2、AlCl3反应生成沉淀而HCl不反应,所以A是NaOH,B是HCl;
5mL、11mL时沉淀质量最大,且相等,为Al(OH)3、Mg(OH)2沉淀,生成两种沉淀消耗5mLNaOH、沉淀完全溶解消耗10mLHCl,相当于酸碱反应,酸碱以1:1反应,二者体积之比为1:2,则c(NaOH):c(HCl)=2:1;
5-6mL时是NaOH溶解氢氧化铝沉淀,消耗1mL,则生成氢氧化铝沉淀消耗NaOH体积应该是3mL,0-5mL为生成Al(OH)3、Mg(OH)2沉淀,其中2mL为生成Mg(OH)2沉淀,所以生成Al(OH)3、Mg(OH)2沉淀消耗NaOH体积分别是3mL、2mL,根据关系式知,c(Al3+):c(Mg2+)=1:1,据此进行解答.
解答 解:根据图象知,MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,加入A立即产生沉淀,NaOH和MgCl2、AlCl3反应生成沉淀而HCl不反应,所以A是NaOH,B是HCl;
5mL、11mL时沉淀质量最大,且相等,为Al(OH)3、Mg(OH)2沉淀,生成两种沉淀消耗5mLNaOH、沉淀完全溶解消耗10mLHCl,相当于酸碱反应,酸碱以1:1反应,二者体积之比为1:2,则c(NaOH):c(HCl)=2:1;
5-6mL时是NaOH溶解氢氧化铝沉淀,消耗1mL,则生成氢氧化铝沉淀消耗NaOH体积应该是3mL,0-5mL为生成Al(OH)3、Mg(OH)2沉淀,其中2mL为生成Mg(OH)2沉淀,所以生成Al(OH)3、Mg(OH)2沉淀消耗NaOH体积分别是3mL、2mL,根据关系式知,c(Al3+):c(Mg2+)=1:1,
A.从加入5 mL A生成沉淀最多,再继续加1 mL A沉淀量减少到最小值,相应反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,由此可知,n(Al3+)=n〔Al(OH)3〕=(1×6×10-3) mol;由前5 mL NaOH形成最大沉淀量可知,2n(Mg2+)+3n(Al3+)=(5×10-3×6)mol,所以n(Mg2+)=(1×6×10-3) mol;溶液中阴阳离子所带电荷相等得,n(Cl-)=(5×10-3×6)mol,即溶液中c(Mg2+):c(Al3+):c(Cl-)=1:1:5,故A正确;
B.根据加入前6 mL试剂时,先有沉淀生成而后溶解,所以试剂A是NaOH,则B是盐酸,故B错误;
C.6~9mL之间为碱与酸反应,由于c(NaOH):c(HCl)=2:1,二者物质的量相等,故二者体积之比为1:2,则发生中和反应的NaOH溶液体积为3mL×$\frac{1}{3}$=1mL,盐酸为3mL-1mL=2mL,故整个过程中NaOH溶液总体积为:6mL+1mL=7mL,盐酸总体积为:2mL+(21-9)mL=14mL,则V(A):V(B)=7:14,故C错误;
D.由6mL和9mL对应液体中沉淀量相等,可以推知此时仅仅发生酸碱中和反应,即H++OH-=H2O,故D正确;
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确图象中曲线变化对应的反应实质为结构件,注意掌握镁离子、铝离子等化学性质,试题培养了学生的化学计算能力.

| A. | 溶液 | B. | 胶体 | ||
| C. | 悬浊液 | D. | 互不相容的两种液体 |
| A. | 等体积等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O | |
| B. | FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| C. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| D. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
| A. | 一定有S2-、SO32-、Na+ | B. | 一定没有Ag+、Al3+ | ||
| C. | 可能只有Na+、S2-、CO32- | D. | 一定有Na+、S2-、NO3 |
| A. | 稀盐酸滴在石灰石上:CO32-+2H+═CO2+H2O | |
| B. | 氯化铝溶液加入过量氨水:Al3++3OH-═Al(OH)3 | |
| C. | 碳酸氢钠溶液中加入稀硝酸:HCO3-+H+═CO2↑+H2O | |
| D. | 铜与硝酸银溶液反应:Cu+Ag+═Ag+Cu2+ |


 、Ⅱ
、Ⅱ .
.