题目内容
9.下列反应的离子方程式正确的是( )| A. | 稀盐酸滴在石灰石上:CO32-+2H+═CO2+H2O | |
| B. | 氯化铝溶液加入过量氨水:Al3++3OH-═Al(OH)3 | |
| C. | 碳酸氢钠溶液中加入稀硝酸:HCO3-+H+═CO2↑+H2O | |
| D. | 铜与硝酸银溶液反应:Cu+Ag+═Ag+Cu2+ |
分析 A.碳酸钙在离子反应中保留化学式;
B.反应生成氢氧化铝和氯化铵;
C.反应生成硝酸钠、水、二氧化碳;
D.电子、电荷不守恒.
解答 解:A.稀盐酸滴在石灰石上的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故A错误;
B.氯化铝溶液加入过量氨水的离子反应为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故B错误;
C.碳酸氢钠溶液中加入稀硝酸的离子反应为HCO3-+H+═CO2↑+H2O,故C正确;
D.铜与硝酸银溶液反应的离子反应为Cu+2Ag+═2Ag+Cu2+,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
19.如图是向MgCl2、AlCl3混合溶液中先滴加试剂A,然后改滴试剂B,所得沉淀的物质的量y(mol) 与试剂体积V(ml)间的关系.以下结论不正确的是( )
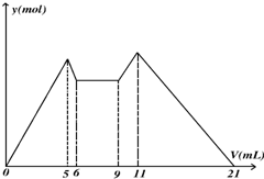

| A. | 原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 | |
| B. | A是NaOH,B是盐酸,且c(NaOH):c(HCl)=2:1 | |
| C. | 若A,B均为一元强酸或者一元强碱,则V(A):V(B)=7:13 | |
| D. | 从6到9,相应离子反应式H++OH-═H2O |
20.相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气;②若不使用催化剂,加热至470℃左右,得到KClO4(高氯酸钾)和KCl.下列关于①和②的说法不正确 的是( )
| A. | 都属于氧化还原反应 | B. | 发生还原反应的元素相同 | ||
| C. | 发生氧化反应的元素不同 | D. | 生成KCl的物质的量为2:1 |
17.下列各物质的名称(或俗名)、化学式、分类都正确的是( )
| A. | 氧化铁 FeO 碱性氧化物 | B. | 碳酸气 CO 酸性氧化物 | ||
| C. | 硫酸 H2S 酸 | D. | 纯碱 Na2CO3 盐 |
4.下列各组离子,能大量共存于同一溶液中的是( )
| A. | CO32-、H+、Na+、NO3- | B. | H+、Ag+、Cl-、SO42- | ||
| C. | K+、Na+、OH-、SO42- | D. | Ba2+、Ca2+、SO42-、OH- |
14.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 23gNa与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4L N2和H2混合气中含NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 |
18.当前,我国许多地区酸雨现象十分严重.酸雨形成的主要原因是( )
| A. | 工业和民用上大量燃烧含硫的化石燃料 | |
| B. | 森林遭到乱砍滥伐,破坏了生态平衡 | |
| C. | 汽车排出大量含碳氧化物的尾气 | |
| D. | 人口膨胀,生活中二氧化碳排放量增加 |
19.同温同压下,加热NaHCO3至完全分解,放出的CO2用Na2O2来吸收,则NaHCO3与Na2O2的最佳物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 2:3 |