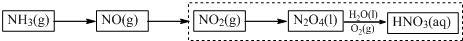题目内容
17.在Ca(NO3)2和Ba(NO3)2的混合溶液中,Ca2+的物质的量浓度为0.25mol/L,NO3-的物质的量浓度为1.5mol/L,求该溶液中Ba2+的物质的量浓度.分析 根据电荷守恒可知:2c(Ca2+)+2c(Ba2+)+c(H+)=c(NO3-)+c(OH-),分析解答.
解答 解:在Ca(NO3)2和Ba(NO3)2都强碱强酸盐溶液呈中性,所以c(H+)=c(OH-),则2c(Ca2+)+2c(Ba2+)=c(NO3-),所以2c(Ba2+)=1.5mol/L-2×0.25mol/L=1mol/L,所以c(Ba2+)=0.5mol/L,
答:溶液中Ba2+的物质的量浓度为0.5mol/L.
点评 本题考查物质的量浓度计算,比较基础,注意对基础知识的理解掌握,根据电荷守恒.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.某烃的结构简式是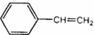 ,它不可能具有的性质是( )
,它不可能具有的性质是( )
 ,它不可能具有的性质是( )
,它不可能具有的性质是( )| A. | 既能使溴水褪色,也能使酸性KMnO4溶液褪色 | |
| B. | 易溶于水和有机溶剂 | |
| C. | 能与H2在一定条件下发生反应 | |
| D. | 能发生加聚反应,生成物可用 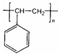 表示 表示 |
8. 向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
 向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )| 序号 | 甲 | 乙 |
| A | 镁条 | 稀硫酸 |
| B | 硫酸铁溶液 | 氢氧化钠溶液 |
| C | 硝酸钡溶液 | 硫酸钠溶液 |
| D | 生锈的铁钉 | 稀硫酸 |
| A. | A | B. | B | C. | C | D. | D |
7.A、B两元素位于短周期,A原子半径小于B原子半径,两元素可形成A是正价的AB2化合物,下列有关A、B两元素的叙述中正确的是( )
| A. | A、B可能属同一周期 | |
| B. | A位于B的前一周期 | |
| C. | A只能是金属元素 | |
| D. | A可能是第二周期的ⅡA族或ⅣA族元素 |
8.下列叙述正确的是( )
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 | |
| B. | 除去FeCl2中少量的FeBr2,加入适量氯水,再加四氯化碳萃取分液 | |
| C. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入KNO3固体,铜粉仍不溶解 | |
| D. | 向AlCl3溶液中滴加1mol/L NaOH溶液10ml,产生白色沉淀;再加入1mol/L NaHSO4溶液10ml,沉淀恰好消失 |