题目内容
三氟化氮(NF3)在微电子工业中有重要用途,它在潮湿的空气中与水蒸气反应的产物有:HF、NO和HNO3.则下列说法正确的是( )
| A、NF3分子中含有非极性共价键 |
| B、NF3在空气中泄漏时不易被察觉 |
| C、一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染 |
| D、反应过程中,被氧化与被还原的元素的物质的量之比为2:1 |
考点:不同晶体的结构微粒及微粒间作用力的区别,氧化还原反应,氯、溴、碘及其化合物的综合应用
专题:化学键与晶体结构
分析:A、NF3分子中只含有极性共价键N-F;
B、NF3在空气中泄漏生成NO,NO与空气反应生成红棕色气体;
C、若NF3泄漏,与水反应产物均与碱反应;
D、NF3与H2O的反应的方程式为3NF3+5H2O(g)=9HF+2NO+HNO3该反应中氧化剂、还原剂都是NF3,氧化产物是NO,结合元素化合价的变化与得失电子的关系解答.
B、NF3在空气中泄漏生成NO,NO与空气反应生成红棕色气体;
C、若NF3泄漏,与水反应产物均与碱反应;
D、NF3与H2O的反应的方程式为3NF3+5H2O(g)=9HF+2NO+HNO3该反应中氧化剂、还原剂都是NF3,氧化产物是NO,结合元素化合价的变化与得失电子的关系解答.
解答:
解:A、NF3分子中只含有N-F,N-F属于极性共价键,故A错误;
B、NF3在空气中泄漏生成NO,NO与空气反应生成红棕色气体,易被察觉,故B错误;
C、若NF3泄漏,与水反应产物均与碱反应,可用石灰水溶液喷淋的方法减少污染,故C正确;
D、在潮湿空气中反应,发生3NF3+5H2O(g)=9HF+2NO+HNO3,反应中氧化剂、还原剂都是NF3,氧化剂与还原剂的物质的量之比为2:1,被氧化与被还原的元素的物质的量之比为1:2,故D错误;
故选C.
B、NF3在空气中泄漏生成NO,NO与空气反应生成红棕色气体,易被察觉,故B错误;
C、若NF3泄漏,与水反应产物均与碱反应,可用石灰水溶液喷淋的方法减少污染,故C正确;
D、在潮湿空气中反应,发生3NF3+5H2O(g)=9HF+2NO+HNO3,反应中氧化剂、还原剂都是NF3,氧化剂与还原剂的物质的量之比为2:1,被氧化与被还原的元素的物质的量之比为1:2,故D错误;
故选C.
点评:本题综合考查氧化还原反应知识,侧重于氧化剂、氧化剂的判断、电子转移的数目的计算等问题,题目难度中等,注意从化合价变化的角度分析氧化还原反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
能证明淀粉已完全水解的试剂是( )
| A、碘水 | B、银氨溶液 |
| C、淀粉碘化钾溶液 | D、碘化钾 |
下列离子方程式书写正确的是( )
A、用浓硫酸与4-溴-1-丁醇加热发生消去反应:BrCH2CH2CH2CH2OH
| ||
| B、过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | ||
| C、向CuSO4溶液中滴加过量的氨水:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+ | ||
| D、用侯氏制碱法制得NaHCO3:Na++NH3+CO2+H2O═NaHCO3↓+NH4+ |
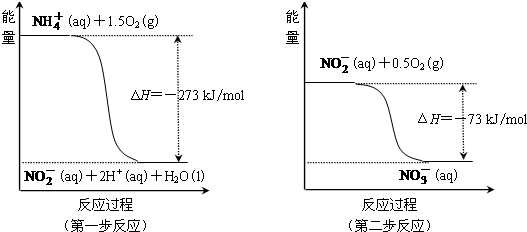
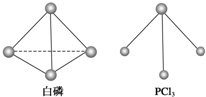 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.