题目内容
 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.(1)已知298K时白磷、红磷完全燃烧的热化学方程式分别为P4(白磷,s)+5O2(g)═P4O10(s)△H1=-2 983.2kJ?mol-1P(红磷,s)+
| 5 |
| 4 |
| 1 |
| 4 |
(2)已知298K时白磷不完全燃烧的热化学方程式为P4(白磷,s)+3O2(g)═P4O6(s)△H=-1 638kJ?mol-1.在某密闭容器中加入62g白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应.则所得到的P4O10与P4O6的物质的量之比为
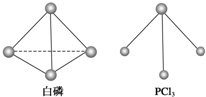
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ?mol-1):P-P 198,Cl-Cl 243,P-Cl 331.则反应P4(白磷,s)+6Cl2(g)═4PCl3(s)的反应热△H=
考点:热化学方程式,反应热和焓变
专题:化学反应中的能量变化
分析:(1)根据盖斯定律写出白磷转化为红磷的热化学方程式;
(2)设P4O10物质的量为x,P4O6物质的量为y,结合原子守恒计算得到,依据热化学方程式计算反应放出的热量;
(3)依据反应焓变△H=反应物键能总和-生成物键能总和得到;
(2)设P4O10物质的量为x,P4O6物质的量为y,结合原子守恒计算得到,依据热化学方程式计算反应放出的热量;
(3)依据反应焓变△H=反应物键能总和-生成物键能总和得到;
解答:
解:(1)P4(s,白磷)+5O2(g)=P4O10(s)△H1=-2983.2kJ/mol…①
P(s,红磷)+
O2(g)=
P4O10(s)△H2=-738.5kJ/mol,…②
根据盖斯定律:①-②×4可得:P4(s,白磷)=4P(s,红磷)△H=(-2983.2kJ/mol)-(-738.5kJ)×4=-29.2kJ/mol;
热化学方程式为:P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol;
故答案为:P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol;
(2)在某密闭容器中加入62g白磷和50.4L氧气(标准状况),白磷中磷原子物质的量=
=2mol原子,氧气物质的量=
=2.25mol,含有4.5mol氧原子;依据原子守恒列式计算:设P4O10物质的量为x,P4O6物质的量为y
4x+4y=2
5x+3y=2.25
计算出x=0.375mol,
y=0.125mol
最后生成0.375molP4O10,0.125molP4O6mol,故物质的量之比为3:1;
P4(白磷,s)+3O2(g)═P4O6(s)△H=-1 638kJ?mol-1;
P4(白磷,s)+5O2(g)═P4O10(s)△H1=-2 983.2kJ?mol-1;
放出的热量=0.375mol×(-2983.2KJ/mol)+0.125 mol×(-1638KJ/mol)=1323.45KJ;
故答案为:3:1;1323.45KJ;
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ?mol-1):P-P 198,Cl-Cl 243,P-Cl 331.则反应P4(白磷,s)+6Cl2(g)═4PCl3(s)的反应热△H=198KJ/mol×6+6×243KJ/mol-4×3×331KJ/mol=-1326KJ/mol;
故答案为:-1326KJ/mol;
P(s,红磷)+
| 5 |
| 4 |
| 1 |
| 4 |
根据盖斯定律:①-②×4可得:P4(s,白磷)=4P(s,红磷)△H=(-2983.2kJ/mol)-(-738.5kJ)×4=-29.2kJ/mol;
热化学方程式为:P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol;
故答案为:P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol;
(2)在某密闭容器中加入62g白磷和50.4L氧气(标准状况),白磷中磷原子物质的量=
| 62g |
| 31g/mol |
| 50.4L |
| 22.4L/mol |
4x+4y=2
5x+3y=2.25
计算出x=0.375mol,
y=0.125mol
最后生成0.375molP4O10,0.125molP4O6mol,故物质的量之比为3:1;
P4(白磷,s)+3O2(g)═P4O6(s)△H=-1 638kJ?mol-1;
P4(白磷,s)+5O2(g)═P4O10(s)△H1=-2 983.2kJ?mol-1;
放出的热量=0.375mol×(-2983.2KJ/mol)+0.125 mol×(-1638KJ/mol)=1323.45KJ;
故答案为:3:1;1323.45KJ;
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ?mol-1):P-P 198,Cl-Cl 243,P-Cl 331.则反应P4(白磷,s)+6Cl2(g)═4PCl3(s)的反应热△H=198KJ/mol×6+6×243KJ/mol-4×3×331KJ/mol=-1326KJ/mol;
故答案为:-1326KJ/mol;
点评:本题考查了物质结构分析,热化学方程式书写和盖斯定律计算应用,原子守恒和化学方程式的计算方法应用,掌握基础是关键,题目难度中等.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一.下列有关元素周期表的说法正确的是( )
| A、元素周期表含元素最多的族是第ⅢB族 |
| B、元素周期表有18个族 |
| C、第ⅠA族的元素全部是金属元素 |
| D、短周期是第一、二、三、四周期 |
三氟化氮(NF3)在微电子工业中有重要用途,它在潮湿的空气中与水蒸气反应的产物有:HF、NO和HNO3.则下列说法正确的是( )
| A、NF3分子中含有非极性共价键 |
| B、NF3在空气中泄漏时不易被察觉 |
| C、一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染 |
| D、反应过程中,被氧化与被还原的元素的物质的量之比为2:1 |
根据氧族元素的性质判断,硒不可能具有的性质是( )
| A、非金属性比溴弱 |
| B、H2Se比H2S稳定 |
| C、SeO3对应的水化物是一种酸 |
| D、有-2、+4、+6三种化合价 |
有13.5g不纯的CuCl2粉末(内含一种杂质),当它与足量的AgNO3溶液反应时,产生了29gAgCl沉淀,则该粉末中的杂质可能是( )
| A、FeCl3 |
| B、CaCl2 |
| C、ZnCl2 |
| D、BaCl2 |
已知:将一定量Cl2通入KOH溶液,可能生成KCl、KClO、KClO3,且
的值与温度高低有关.当n(KOH)=6a mol时,下列有关说法错误的是( )
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后
| ||||||
| B、参加反应的氯气的物质的量等于3a mol | ||||||
| C、改变温度,反应中转移电子的物质的量ne的范围:3a mol<ne<5a mol | ||||||
| D、改变温度,产物中KClO3的最大理论产量为a mol |

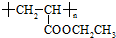 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为