题目内容
用18mol/L的硫酸配制100mL 1.0mol/L的硫酸,若实验仪器有:A.100mL量筒;B.托盘天平;C.玻璃棒;D.50mL容量瓶;E.10mL量筒; F.胶头滴管;G.50mL烧杯;H.100mL容量瓶.
(1)实验时应该选用的仪器是 .(填入字母)
(2)在容量瓶的使用方法中,下列操作不正确的是 .(填入字母)
A.使用容量瓶之前检查它是否漏水.
B.容量瓶用蒸馏水洗干净后,再用待测溶液润洗.
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线2~3cm处,用滴管滴加蒸馏水到标线.
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2cm处,用滴管滴加蒸馏水到标线.
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次.
(3)配制中,下列的操作会使浓度偏低的是 .(填入字母)
A.用量筒量取浓硫酸时,仰视读数.
B.浓硫酸溶解后转移时,烧杯没有洗涤.
C.用玻璃棒引流,将溶液转移到容量瓶中有溶液流到了容量瓶外面.
D.用量筒量取浓硫酸时,把量筒也洗涤,洗涤液转移到容量瓶.
E.用胶头滴管加蒸馏水时,加入过快而使液面超过了刻度线,立即用滴管吸去多余的水,使凹液面刚好与刻度线相切.
F.定容摇匀后,发现液面比刻度线低,再加水到刻度线.
(1)实验时应该选用的仪器是
(2)在容量瓶的使用方法中,下列操作不正确的是
A.使用容量瓶之前检查它是否漏水.
B.容量瓶用蒸馏水洗干净后,再用待测溶液润洗.
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线2~3cm处,用滴管滴加蒸馏水到标线.
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2cm处,用滴管滴加蒸馏水到标线.
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次.
(3)配制中,下列的操作会使浓度偏低的是
A.用量筒量取浓硫酸时,仰视读数.
B.浓硫酸溶解后转移时,烧杯没有洗涤.
C.用玻璃棒引流,将溶液转移到容量瓶中有溶液流到了容量瓶外面.
D.用量筒量取浓硫酸时,把量筒也洗涤,洗涤液转移到容量瓶.
E.用胶头滴管加蒸馏水时,加入过快而使液面超过了刻度线,立即用滴管吸去多余的水,使凹液面刚好与刻度线相切.
F.定容摇匀后,发现液面比刻度线低,再加水到刻度线.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)先根据稀释前后溶质的物质的量不变,计算出浓溶液的体积,选取合适的量筒,再根据配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容、摇匀等操作选择其它仪器;
(2)根据容量瓶的构造及正确的使用方法进行判断;
(3)分析操作对溶质的物质的量、溶液的体积的影响,根据c=
判断对浓度的影响.
(2)根据容量瓶的构造及正确的使用方法进行判断;
(3)分析操作对溶质的物质的量、溶液的体积的影响,根据c=
| n |
| V |
解答:
解:(1)稀释前后溶质的物质的量不变,设需要浓硫酸的体积为V,则18mol/L×V=100mL×1.0mol/L,解得V=5.6ml,所以应选择10ml的量筒,用浓硫酸配置一定物质的量浓度稀溶液的一般步骤为:计算需要浓硫酸体积,用量筒量取浓硫酸,在烧杯中稀释冷却,转移到容量瓶中,洗涤,定容,摇匀,所以用到的仪器有:
C.玻璃棒;E.10mL量筒; F.胶头滴管;G.50mL烧杯;H.100mL容量瓶;
故答案为:C、E、F、G、H;
(2)A.使用容量瓶需要上下颠倒,所以使用前应查漏,故A正确;
B.容量瓶用待测液润洗,造成溶液浓度偏高,故B错误;
C.容量瓶为精密仪器,固体溶解放出大量的热,导致溶液的体积不准确,产生误差,故C错误;
D.容量瓶为精密仪器,浓溶液稀释时产生大量的热,导致溶液的体积不准确,产生误差,故D错误;
E.摇匀使溶液混合均匀,故E正确;
故答案为:BCD;
(3)A.用量筒量取浓硫酸时,仰视读数,导致量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液的浓度偏高,故A不选;
B.浓硫酸溶解后转移时,烧杯没有洗涤,导致溶质的物质的量偏小,溶液的浓度偏低,故B选;
C.用玻璃棒引流,将溶液转移到容量瓶中有溶液流到了容量瓶外面,导致溶质的物质的量偏小,溶液的浓度偏低,故C选;
D.用量筒量取浓硫酸时,把量筒也洗涤,洗涤液转移到容量瓶,导致量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液的浓度偏高,故D不选;
E.用胶头滴管加蒸馏水时,加入过快而使液面超过了刻度线,立即用滴管吸去多余的水,使凹液面刚好与刻度线相切,吸出的液体中含有溶质,导致溶质的物质的量偏小,溶液的浓度偏低,故E选;.
F.定容摇匀后,发现液面比刻度线低,再加水到刻度线,导致溶液的体积偏大,溶液的浓度偏低,故F选;
故选:BCEF.
C.玻璃棒;E.10mL量筒; F.胶头滴管;G.50mL烧杯;H.100mL容量瓶;
故答案为:C、E、F、G、H;
(2)A.使用容量瓶需要上下颠倒,所以使用前应查漏,故A正确;
B.容量瓶用待测液润洗,造成溶液浓度偏高,故B错误;
C.容量瓶为精密仪器,固体溶解放出大量的热,导致溶液的体积不准确,产生误差,故C错误;
D.容量瓶为精密仪器,浓溶液稀释时产生大量的热,导致溶液的体积不准确,产生误差,故D错误;
E.摇匀使溶液混合均匀,故E正确;
故答案为:BCD;
(3)A.用量筒量取浓硫酸时,仰视读数,导致量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液的浓度偏高,故A不选;
B.浓硫酸溶解后转移时,烧杯没有洗涤,导致溶质的物质的量偏小,溶液的浓度偏低,故B选;
C.用玻璃棒引流,将溶液转移到容量瓶中有溶液流到了容量瓶外面,导致溶质的物质的量偏小,溶液的浓度偏低,故C选;
D.用量筒量取浓硫酸时,把量筒也洗涤,洗涤液转移到容量瓶,导致量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液的浓度偏高,故D不选;
E.用胶头滴管加蒸馏水时,加入过快而使液面超过了刻度线,立即用滴管吸去多余的水,使凹液面刚好与刻度线相切,吸出的液体中含有溶质,导致溶质的物质的量偏小,溶液的浓度偏低,故E选;.
F.定容摇匀后,发现液面比刻度线低,再加水到刻度线,导致溶液的体积偏大,溶液的浓度偏低,故F选;
故选:BCEF.
点评:本题考查了一定物质的量浓度溶液的配制,难度中等,明确配置原理、熟悉配置过程是解题关键,注意根据c=
理解溶液配制原理与误差分析.
| n |
| V |

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
实验室融化NaOH固体,不能选用的坩埚是( )
| A、铁坩埚 | B、石墨坩埚 |
| C、石英坩埚 | D、氧化铝坩埚 |
下列是能与金属钠反应的系列物质,在排列H2O、C6H5OH、□CH3COOH、HCl中,□内应填入的物质是( )
| A、H2SO4 |
| B、CH3CH2OH |
| C、H2CO3 |
| D、CH3COOCH3 |
三氟化氮(NF3)在微电子工业中有重要用途,它在潮湿的空气中与水蒸气反应的产物有:HF、NO和HNO3.则下列说法正确的是( )
| A、NF3分子中含有非极性共价键 |
| B、NF3在空气中泄漏时不易被察觉 |
| C、一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染 |
| D、反应过程中,被氧化与被还原的元素的物质的量之比为2:1 |
下列反应的离子方程式书写正确的是( )
| A、稀醋酸与氢氧化钠溶液的反应:H++OH-═H2O |
| B、铜粉与稀硝酸的反应:Cu+2H+═Cu2++H2↑ |
| C、氯气与碘化钾溶液的反应:Cl2+I-═Cl-+I2 |
| D、碳酸钠溶液与足量稀盐酸的反应:CO32-+2H+═H2O+CO2↑ |
根据氧族元素的性质判断,硒不可能具有的性质是( )
| A、非金属性比溴弱 |
| B、H2Se比H2S稳定 |
| C、SeO3对应的水化物是一种酸 |
| D、有-2、+4、+6三种化合价 |
已知:将一定量Cl2通入KOH溶液,可能生成KCl、KClO、KClO3,且
的值与温度高低有关.当n(KOH)=6a mol时,下列有关说法错误的是( )
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后
| ||||||
| B、参加反应的氯气的物质的量等于3a mol | ||||||
| C、改变温度,反应中转移电子的物质的量ne的范围:3a mol<ne<5a mol | ||||||
| D、改变温度,产物中KClO3的最大理论产量为a mol |
 )广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多.
)广泛存在于水果中,尤以苹果、葡萄、西瓜、山楂内为多.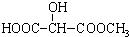 B.
B. C.H3COOC-COOCH3
C.H3COOC-COOCH3 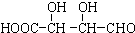 E.
E.