题目内容
2.下列除杂操作可行的是( )| A. | 通过浓硫酸除去SO2中的H2O | B. | 通过灼热的CuO除去H2中的CO | ||
| C. | 通过灼热的镁粉除去N2中的O2 | D. | 通过碱石灰除去O2中的NH3 |
分析 A.浓硫酸具有吸水性,与二氧化硫不反应;
B.二者均与CuO反应;
C.二者均与Mg反应;
D.碱石灰不能与氨气反应.
解答 解:A.浓硫酸具有吸水性,与二氧化硫不反应,则洗气可除杂,故A正确;
B.二者均与CuO反应,不能除杂,故B错误;
C.二者均与Mg反应,不能除杂,故C错误;
D.碱石灰不能与氨气反应,不能除杂,应选浓硫酸、洗气,故D错误;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、除杂原则为解本题关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列过程吸收热量的是( )
| A. | 水凝结成冰 | B. | 天然气燃烧 | ||
| C. | 盐酸与氢氧化钠中和反应 | D. | 液氨气化 |
10.某无色溶液中可能含有Na+、NH4+、Ba2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种.为检验其中含有的离子,进行如下实验:
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体.
下列关于原溶液的说法正确的是( )
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体.
下列关于原溶液的说法正确的是( )
| A. | 肯定存在NH4+、Cl-、Br- | |
| B. | 是否存在Na+需要通过焰色反应来确定 | |
| C. | SO42-、SO32-至少含有一种 | |
| D. | 肯定不存在Ba2+、Cu2+、SO32-、CO32- |
17.一定条件下,一种反应物过量,另一种反应物可以完全反应的是( )
| A. | 过量的氧气与二氧化硫 | B. | 过量的氢氧化钠与二氧化硅 | ||
| C. | 过量的二氧化锰与浓盐酸 | D. | 过量的铜与浓硫酸 |
14.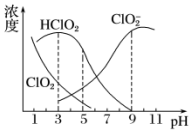 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )
亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )
 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )
亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数值Ka约为10-6 | |
| C. | 使用该漂白剂的最佳pH为3 | |
| D. | ClO2可用于自来水的消毒 |
16.根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
| 选项 | 事实 | 推测 |
| A. | Na与冷水反应剧烈,K与冷水反应更剧烈 | Li与冷水反应缓慢 |
| B. | 20Ca(OH)2碱性强于12Mg(OH)2 | 38Sr(OH)2碱性强于20Ca(OH)2 |
| C. | Si是半导体材料,同主族的Ge也是半导体材料 | 第ⅣA元素形成的单质都是半导体材料 |
| D. | F2与H2在暗处剧烈化合,Cl2与H2光照或点燃时反应 | Br2与H2反应需要加热到一定温度 |
| A. | A | B. | B | C. | C | D. | D |
