题目内容
12.下列过程吸收热量的是( )| A. | 水凝结成冰 | B. | 天然气燃烧 | ||
| C. | 盐酸与氢氧化钠中和反应 | D. | 液氨气化 |
分析 物质在溶解时经常伴随有吸热或放热现象,氢氧化钠固体、浓硫酸溶于放出大量的热,温度升高;硝酸铵固体溶于水吸热,温度降低,电离、水解都是吸热过程;
常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),以此解答该题.
解答 解:A.水凝结成冰,释放能量,故A不选;
B.物质燃烧属于放热过程,故B不选;
C.中和反应为放热反应,故C不选;
D.液氨气化,由液态变为气态,需要吸热,故D选.
故选D.
点评 本题考查化学中吸热或放热问题,为高频考点,侧重考查学生的双基,熟记吸热或放热的判断规律是正确解答此类题的关键,对于特殊过程中的热量变化的要熟练记忆,难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
2.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 19gNHD2和19gNH2T中含有的中子数均为10NA | |
| B. | 标准状况下,22.4LO2参加反应转移的电子数一定是4NA | |
| C. | 1molCnH2n中含有的共用电子对数为(3n+1)NA | |
| D. | 2molSO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
17.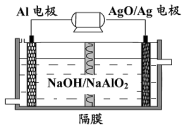 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.电池反应为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O下列说法中错误的是( )
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.电池反应为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O下列说法中错误的是( )
 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.电池反应为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O下列说法中错误的是( )
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.电池反应为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O下列说法中错误的是( )| A. | 该装置可实现化学能向电能的转化 | B. | 电池工作时AgO得到电子 | ||
| C. | Al是负极 | D. | OH-透过隔膜向AgO/Ag极迁移 |
4.下列实验设计,不能达到实验目的是( )
| A. | 用CCl4将溴从溴水中提取出来 | |
| B. | 用丁达尔效应鉴别淀粉胶体和食盐溶液 | |
| C. | 采用加热的方法除去碳酸钠固体中混有的碳酸氢钠 | |
| D. | 向某无色溶液中加入硝酸银产生白色沉淀,证明溶液中含有Cl- |
1.某次硫酸铜晶体结晶水含量的测定实验中,相对误差为-2.7%,原因可能是( )
| A. | 实验时坩埚未完全干燥 | B. | 加热后固体颜色有少量变黑 | ||
| C. | 加热过程中晶体有少量溅失 | D. | 加热后固体未放入干燥器中冷却 |
2.下列除杂操作可行的是( )
| A. | 通过浓硫酸除去SO2中的H2O | B. | 通过灼热的CuO除去H2中的CO | ||
| C. | 通过灼热的镁粉除去N2中的O2 | D. | 通过碱石灰除去O2中的NH3 |
