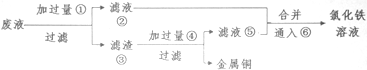
题目内容
7.在水溶液中能大量共存的离子组是( )| A. | Mg2+、Cl-、OH- | B. | Na+、CO32-、OH- | C. | Fe2+、H+、CO32- | D. | Fe3+、K+、OH- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.Mg2+、OH-结合生成沉淀,不能大量共存,故A错误;
B.该组离子之间不反应,可大量共存,故B正确;
C.Fe2+、H+分别于CO32-结合生成沉淀、气体和水,不能大量共存,故C错误;
D.Fe3+、OH-结合生成沉淀,不能大量共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
17.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使酚酞呈红色的溶液:Na+、NH4+、Al3+、NO3- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1mol•L-1的溶液:Na+、K+、CO32-、ClO- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | 由水电离产生的c(OH-)=1×10-14mol•L-1溶液:K+、Na+、Cl-、HCO3- |
18.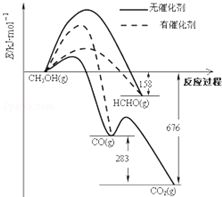 (1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去).
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去).
①在有催化剂作用下,CH3OH与O2反应主要生成HCHO;(填“CO、CO2”或“HCHO”)
②2HCHO(g)+O2(g)═2CO(g)+2H2O(g)△H=-470KJ•mol-1;
(2)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
经测定不同温度下该反应的平衡常数如表:
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4mol•L-1、c(H2)=0.4mol•L-1、c(CH3OH)=0.8mol•L-1,则此时V正<V逆(填“>”、“<”或“=”).
 (1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去).
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去).①在有催化剂作用下,CH3OH与O2反应主要生成HCHO;(填“CO、CO2”或“HCHO”)
②2HCHO(g)+O2(g)═2CO(g)+2H2O(g)△H=-470KJ•mol-1;
(2)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
经测定不同温度下该反应的平衡常数如表:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
2.现有下列试剂:①氯水 ②Br2水 ③碘水 ④O3 ⑤NO2 ⑥稀硝酸,其中能使淀粉碘化钾溶液变蓝的是( )
| A. | ①②⑥ | B. | ④⑤ | C. | 除③外 | D. | 全部 |
12.下列反应不属于氧化还原反应的是( )
| A. | Na2O+H2O=2NaOH | B. | Zn+H2SO4=ZnSO4+H2↑ | ||
| C. | 2Na+Cl2=2NaCl | D. | Cl2+2KI=2KCl+I2 |
19.将BaO2放入密闭真容器中,反应2BaO2(s)?2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
| A. | 平衡常数减小 | B. | BaO量不变 | C. | 氧气压强不变 | D. | 氧气的浓度变大 |