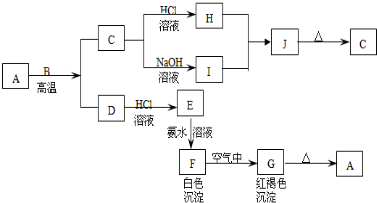
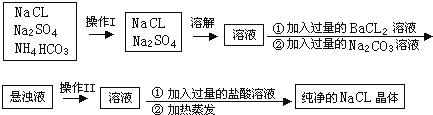
题目内容
如表中物质的分类组合完全正确的是( )
| 编 号 | A | B | C | D |
| 强电解质 | KNO3 | H2SO4 | Ba(OH)2 | BaSO4 |
| 弱电解质 | CH3COOH | CaCO3 | H2S | NH3?H2O |
| 非电解质 | SO2 | CO2 | Cl2 | C2H5OH溶液 |
| A、A | B、B | C、C | D、D |
考点:电解质与非电解质,强电解质和弱电解质的概念
专题:
分析:强电解质是指完全电离成离子的化合物;弱电解质是指不完全电离,只有部分电离的化合物;在水溶液里和熔融状态下都不导电的化合物是非电解质.
解答:
解:A、硝酸钾溶于水完全电离,所以硝酸钾是强电解质;乙酸在水中只有部分电离,所以属于弱电解质;二氧化硫的水溶液能导电,是因为二氧化硫和水结合为亚硫酸导电,二氧化硫本身不电离,所以二氧化硫是非电解质,故A正确.
B、碳酸钙熔融状态完全电离,所以是强电解质,故B错误.
C、氯气是单质不是化合物,所以氯气不是非电解质,故C错误.
D、乙醇溶液是混合物,所以不属于非电解质,故D错误;
故选A.
B、碳酸钙熔融状态完全电离,所以是强电解质,故B错误.
C、氯气是单质不是化合物,所以氯气不是非电解质,故C错误.
D、乙醇溶液是混合物,所以不属于非电解质,故D错误;
故选A.
点评:本题考查了强电解质、弱电解质和非电解质的判断,明确电解质的强弱与电离程度有关,与溶液的导电能力大小无关.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
以CH3COOH?CH3COO-+H+的电离平衡为例:回答下列问题:
| 改变条件 | 平衡移动方向 | C(H+)C(OH-)C(CH3COO-)电离程度的变化 |
| 加入镁粉 | ||
| 升高温度 | ||
| 通入NaOH(s) | ||
| 通入HCl(g) |
下列物质中,不能电离出酸根离子的是( )
| A、Na2SO3 |
| B、Ba(OH)2 |
| C、KMnO4 |
| D、KCl04 |
下列有关溶液组成的描述合理的是( )
| A、常温下,水电离出的c(H+)=1×10-12mol/L,某无色溶液中不可能大量存在:Al3+、NH4+、Cl-、S2- |
| B、pH=2的溶液中,可能大量存在:Na+、Fe2+、ClO-、SO42- |
| C、常温下某溶液中KW/c(H+)=1×10-12,溶液中可能大量存在:Na+、NH4+、Cl-、HCO3- |
| D、某溶液中加入少量Al 有气体生成,溶液中可能大量存在:Na+、K+、Cl-、NO3- |
等质量的下列物质分别与盐酸反应,消耗HCl的物质的量最少的是( )
| A、Na |
| B、Na2O2 |
| C、Na2CO3 |
| D、Ca(HCO3)2 |